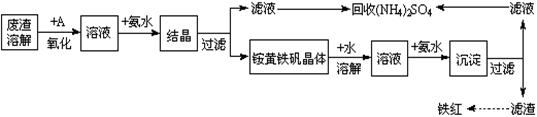
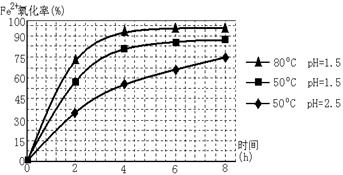
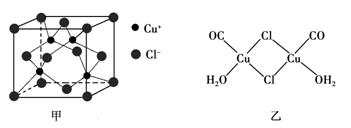
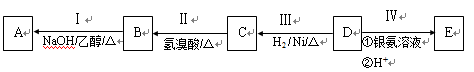
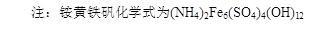-
下列关于有机物的正确说法是
A.三氯甲烷可以做麻醉剂,它和四氯化碳都是重要的有机溶剂
B.石油液化气、天然气、脂肪和石蜡的主要成分都是碳氢化合物
C.乙烯和甲苯均能与酸性高锰酸钾(或溴水)发生氧化还原反应
D.能与NaOH溶液反应且分子式为C2H4O2的有机物一定是乙酸
难度: 中等查看答案及解析
-
下列说法错误的是
A.某物质只含有一种元素,则该物质可能为混合物
B.16O与18O互为同位素,且核外电子排布方式相同
C.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH相同
D.氧化还原反应中,一种元素化合价上升,一定有另一种元素化合价下降
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是(相对原子质量:H 1,N 14)
A.1.8g的NH4+离子中含有NA个电子
B.标准状况下,22.4L水中含有NA个H2O分子
C.常温常压下,33.6 L Cl2中含有1.5NA个C12分子
D.1 mol·L-1 Na2SO4溶液中有2NA个Na+
难度: 中等查看答案及解析
-
下列实验推理中,正确的是
A.实验时剩余的药品不能放回原瓶,所以实验时剩余的白磷也不能放回原瓶
B.某种气体通入品红溶液中,品红褪色,该气体一定是SO2
C.焰色反应时观察到黄色火焰,说明样品中一定含钠元素可能含钾元素
D.将铜片放入浓硫酸中,无明显现象,说明铜在冷浓硫酸中发生钝化
难度: 中等查看答案及解析
-
将铜丝烧热,迅速插入氢气中,发生反应:CuO+H2
Cu+H2O。若用下列物质代替氢气进行上述实验:①一氧化碳、②稀硝酸、③稀盐酸、④乙醇,铜丝表面所观察到的现象、铜丝质量变化情况与上述实验完全相同的是
A. ①②③ B. ①④ C. ①③④ D. 只有①
难度: 中等查看答案及解析
-
常温时,下列关于溶液的pH或微粒的物质的量浓度的说法不正确的是
A.pH = 3的二元弱酸H2R溶液与pH = 11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液中:2c ( R2+ ) + c ( HR- ) = c ( Na+ )
B.某溶液中只存在Cl-、OH-、NH4+、H+四种离子,则一定不存在下列关系:
c ( Cl- ) > c ( NH4+ ) > c ( H+ ) = c ( OH- )
C.某物质的溶液中由水电离出的c ( H+ ) = 1×10-a mol·L-1,若a > 7,则溶液的pH一定为14 - a
D.将0.2 mol·L-1的某一元酸HA溶液和0.1 mol·L-1NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液中:2c( OH- ) + c( A- ) =2c( H+ ) + c( HA )
难度: 中等查看答案及解析
-
与下列图像有关的说法正确的是
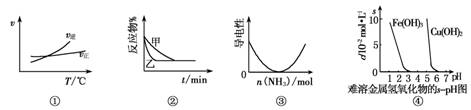
A.根据图①可判断A2(g)+3B2(g)
2AB3(g)的ΔH>0
B.图②表示压强对2A(g)+B(g)
3C(g)的影响,甲的压强大
C.图③表示乙酸溶液中通入氨气后溶液导电性的变化
D.根据图④,调节溶液的pH 为4即可除去CuSO4溶液中的Fe3+
难度: 中等查看答案及解析