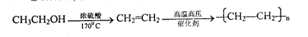-
以节能减排为基础的低碳经济是保持社会可持续发展的战略举措。下列做法违背发展低碳经济的是 ( )
A.尽量用纯液态有机物代替水作溶剂
B.限制塑料制品的使用
C.提高原子利用率,发展绿色化学
D.发展氢能和太阳能
难度: 简单查看答案及解析
-
下列化学用语或命名正确的是 ( )
A.Cl-的结构示意图:
B.NH4Cl的电子式:
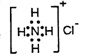
C.丙烯的实验式(最简式):CH2 D.
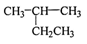 的名称:2-乙基丙烷
的名称:2-乙基丙烷难度: 简单查看答案及解析
-
下列离子方程式式书写正确的是 ( )
A.明矾溶液中加入过量的氢氧化钡溶液:
Al3++2SO42++2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O
B.氯气溶于水:Cl2+H2O=2H++Cl-+ClO-
C.苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32-
D.硝酸亚铁溶液和稀盐酸混合:Fe2++4H++NO3-=Fe3++2H2O+NO↑
难度: 简单查看答案及解析
-
下列有关说法错误的是 ( )
A.利用铝热反应可以冶炼熔点较高的金属
B.用作“钡餐”的物质主要成分是硫酸钡
C.常温下,可以用铁制容器来盛装冷的浓硫酸
D.人造刚玉熔点很高,可用作高级耐火材料,其主要成分是二氧化硅
难度: 简单查看答案及解析
-
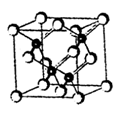
设nA为阿伏加德罗常数的值,下列叙述正确的是 ( )
A.常温常压下,16g14CH4所含中子数目为8nA
B.标准状况下,22.4 LCCl4所含分子数目为nA
C.1 L 0.5 mol·L-1的CH3COONa溶液中所含的CH3COO-离子数目为0.5n
D.6.2g白磷(分子式为P4,分子结构如右图所示)所含P-键数目为0.3nA

难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是 ( )
A.无色透明的溶液中:MnO4、SO42-、K+、Fe2+
B.pH=1的溶液中:NH4+、Na+、SO42-、Fe3+
C.c(SO32-)=0.5 mol·L-1的溶液中:ClO-、Na+、Cl-、CO32-
D.水电离产生的c(H+)=1×10-14mol·L-1的溶液中:HCO3-、NH4+、Cl-、Ca2+
难度: 简单查看答案及解析
-
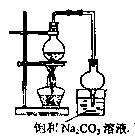
下列实验装置和操作正确的是 ( )
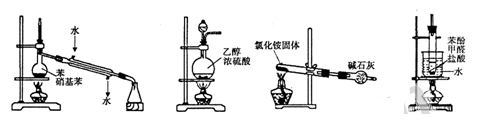
A.分离苯和硝基苯 B.制取乙烯
C.制取氨气 D.制备酚醛树脂
难度: 简单查看答案及解析
-
下表中的实验操作能达至实验目的或得出相应结论的是 ( )
选项
实验操作
实验目的或结论
A
向盛有1mL 0.01mol·L-1AgNO3溶液的试管中滴加0.01mol·L-1NaCl溶液,至不再有沉淀生成,再向其中滴加 0.01mol·L-1Nal溶液,产生黄色沉淀。
常温下,Ksp(AgCl)>Ksp(Agl)
B
C2H5Br与NaOH溶液混合充分振荡,再加入AgNO3溶液
检验C2H5Br中的溴元素
C
向某溶液中加入2滴KSCN溶液,溶液不显红色;再向溶液中加入几滴新制的氯水,溶液变为红色
说明溶液中一定含有Fe2+
D
将少量某物质滴加到新制的氢氧化铜悬浊液中,加热后有红色沉淀生成
说明该物质一定是醛
难度: 简单查看答案及解析
-
常温下,向10mL 0.1 mol·L-1NaOH溶液中逐滴加入0.1mol·L-1醋酸溶液,所得滴定曲线如右图所示。下列说法正确的是 ( )
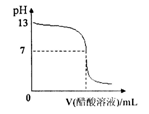
A.pH=7时,所加醋酸溶液的体积为10mL
B.pH<7时,溶液中c(CH3COO-)>c(Na+)
C.7<pH<13时,溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.继续滴加0.1 mol·L-1醋酸溶液,溶液pH可以变为1
难度: 简单查看答案及解析
-
人工合成的一种甜味剂的结构简式如右图所示下列说法正确的是 ( )
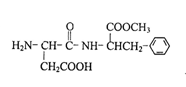
A.分子式是C14H19N2O5
B.该物质分子中含有2个手性碳原子
C.该物质能发生取代、加成、缩聚反应
D.1 mol该物质与NaOH溶液反应,最多消耗2 mol NaOH
难度: 简单查看答案及解析
-
如图装置(I)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池放电、充电的化学方程式为:2K2S2+KI3
K2S4+3KI。装置(II)为电解池的示意图。当闭合开关K时,电极X附近溶液先变红。则闭合K时,下列说法正确的是 ( )
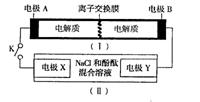
A.K+从右到左通过离子交换膜
B.电极A上发生的反应为:3I--2e-=I3-
C.电极X上发生的反应为:2Cl--2e-=C12↑
D.当有0.1 mol K+通过离子交换膜,X电极上产生1.12 L气体(标准状况)
难度: 简单查看答案及解析
-
下列说法正确的是 ( )
A.分散系中分散质粒子的大小:Fe(OH)3悬浊液<Fe(OH)3胶体<FeCl3溶液
B.可利用反应2CO=2C+O2(
H>O、
S<0)来消除CO污染
C.若弱酸HA的酸性强于弱酸HB,则相同物质的量浓度的钠盐溶液的碱性:NaA<NaB
D.除去Cu粉中混有的CuO,可将混合物加入稀硝酸中,充分反应后过滤、洗涤
难度: 简单查看答案及解析
-
J、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右下表。已知:J元素最低负化合价的绝对值与其原子最外层电子数相等,M是地壳中含量最多的金属元素。下列说法错误的是 ( )

A.J和氢组成的化合物分子中只含有极性共价键
B.工业上用电解M和T组成的化合物来制备M
C.R、T两元素的气态氢化物中,T的气态氢化物更稳定
D.J、M、R、T元素最高价氧化物对应的水化物中酸性最强的是HTO4
难度: 简单查看答案及解析
-
相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中发生可逆反应:
2SO2(g)+O2(g)
2SO3(g);
。实验测得起始、平衡时的有关数据如下表:
容器
起始各物质的物质的量/mol
达到平衡时体系能量的变化
SO2
O2
SO3
Ar
甲
2
1
0
0
放出热量:Q1
乙
1.8
0.9
0.2
0
放出热量:Q2
丙
1.8
0.9
0.2
0.1
放出热量:Q3
下列叙述正确的是 ( )
A.Q1=Q2=Q3=197 kJ
B.达到平衡时,丙容器中SO2的体积分数最大
C.甲、乙、丙3个容器中反应的平衡常数相等
D.若在上述条件下反应生成2molSO3(s)的反应热为△H1,则△H1<-197 kJ·mol-1
难度: 简单查看答案及解析
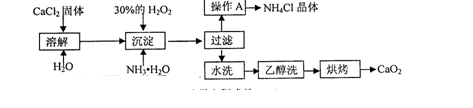
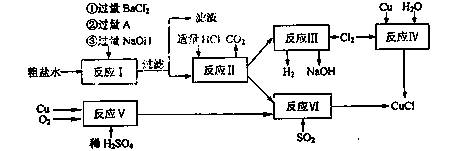
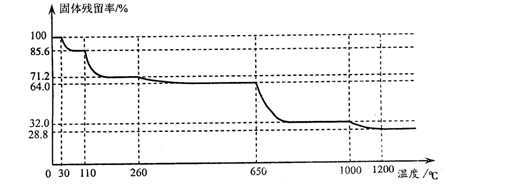
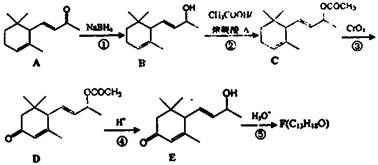
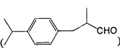 )也是一种重要的香料,主要用于食品、化妆品等工业中。请设计合理方案,以对异丙基苯甲醛(
)也是一种重要的香料,主要用于食品、化妆品等工业中。请设计合理方案,以对异丙基苯甲醛(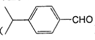 )和丙醛为原料合成兔耳草醛(用合成路线流程图表示,并注明反应条件)。
)和丙醛为原料合成兔耳草醛(用合成路线流程图表示,并注明反应条件)。