-
下列说法正确的是( )
A.红宝石、水晶、钻石的主要成分都是硅酸盐
B.石油裂解、煤的气化、海水制镁都包含化学变化
C.二氧化碳、甲烷、氮气都是造成温室效应的气体
D.油脂、纤维素、蛋白质都是高分子化合物难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.0.5mol/L MgCl2溶液中Cl-的数目为NA
B.58g乙烯和乙烷的混合气体中碳原子数目一定为4NA
C.常温常压下,22.4LNO和N2的混合气体中分子数目大于NA
D.标准状况下,0.5mol氦气含有的电子数为NA难度: 中等查看答案及解析
-
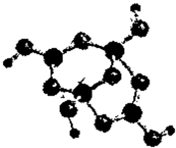
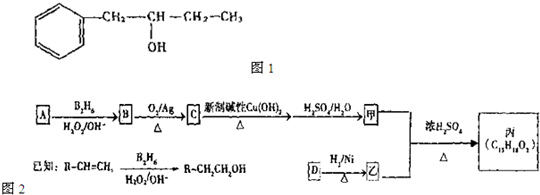
如图是合成香料香豆素过程的中间产物,关于该物质的说法不正确的是( )
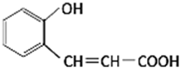
A.分子式为C9H8O3
B.有两种含氧官能团
C.1mol该物质最多能与5molH2发生加成反应
D.该物质在一定条件下可发生酯化反应难度: 中等查看答案及解析
-
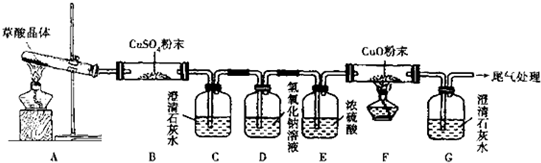
下列实验操作,对实验结果不产生影响的是( )
A.用酸碱中和滴定法测定未知浓度的碱液时,加入甲基橙或酚酞1~2 mL
B.用托盘天平称量4.2gNaCl时,左盘放砝码,右盘放NaCl
C.用pH试纸测定90℃时纯水的pH
D.配制一定物质的量浓度的溶液时,容量瓶用蒸馏水洗净后未干燥难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.Ca(HCO3)2溶液中滴入过量NaOH溶液:HCO+Ca2++OH-=CaCO3↓+H2O
B.向NaAlO2溶液中通入过量的CO2:CO2+2H2O+A1O2=Al(OH)3↓+HCO
C.0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液等体积混合:A13++2SO42-+2Ba2++4OH-=2BaSO4↓+A1O+2H2O
D.向Ca(C1O)2溶液中通入过量的SO2:C1O-+SO2+H2O=HClO+HSO难度: 中等查看答案及解析
-
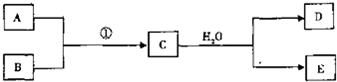
下列各图叙述正确的是( )

A.甲表示H2与O2发生反应过程中的能量变化,H2的燃烧热为△H=-241.8kJ/mol
B.乙表示恒温恒容条件下反应2NO2(g)⇌N2O4(g)中,各物质的浓度与其速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
D.丁表示室温下,将1.000mol/L盐酸滴入20.00mL l.000moL/L氨水中,溶液pH和温度随加入盐酸体积变化曲线难度: 中等查看答案及解析
-
a molNa2O2和b molNaHCO3固体混合后,在密闭容器中加热到250℃,使其充分反应,当排出O2和H2O的物质的量为1:1时,a:b为( )
A.1:1
B.1:2
C.2:3
D.2:1难度: 中等查看答案及解析