-
化学在环境保护、资源利用等与社会可持续发展密切相关的领域发挥着积极作用。下列说法错误的是
A.“APEC蓝”是2014年新的网络词汇,形容2014年APEC会议期间北京蓝蓝的天空。说明京津冀实施道路限行和污染企业停工等措施,对减轻雾霾、保证空气质量是有效的
B.“地沟油”经过加工处理后,可以用来制肥皂和生物柴油
C.生石灰、铁粉、硅胶是食品包装中常用的干燥剂
D.有机垃圾发酵生产沼气
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列叙述正确的是
A.标准状况下,11.2 L SO3所含的分子数为0.5 NA
B.12 g石墨和C60的混合物中质子总数一定为6NA个
C.在熔融状态下,l mol NaHSO4完全电离出的阳离子数目为2NA
D.氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
难度: 中等查看答案及解析
-
在“石蜡→液体石蜡→石蜡蒸气→裂化气”的变化过程中,被破坏的作用力依次是
A.范德华力、范德华力、范德华力 B.范德华力、范德华力、共价键
C.范德华力、共价键、共价键 D.共价键、共价键、共价键
难度: 中等查看答案及解析
-
已知:NH3·H2O(aq)与H2SO4(aq)反应生成1 mol正盐的ΔH=-24.2 kJ·mol-1;强酸、强碱稀溶液反应的中和热为ΔH=-57.3 kJ·mol-1。则NH3·H2O在水溶液中电离的ΔH等于
A.-69.4 kJ·mol-1 B.-45.2 kJ·mol-1
C.+69.4 kJ·mol-1 D.+45.2 kJ·mol-1
难度: 简单查看答案及解析
-
某溶液可能含有Cl﹣、SO42﹣、CO32﹣、NH4+、Fe3+、Al3+和K+.取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀.由此可知有关原溶液中离子的说法不正确是
A. 至少存在4种离子
B. Cl﹣一定存在,且c(Cl﹣)≥0.4mol/L
C. SO42﹣、NH4+一定存在
D. CO32﹣、Al3+、K+一定不存在
难度: 困难查看答案及解析
-
下列离子方程式正确的是
A.0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液等体积混合
NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O
B.FeCl2酸性溶液放在空气中变质:2Fe2++4H++O2===2Fe3++2H2O
C.用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
D.电解MgCl2水溶液的离子方程式:2Cl-+2H2O
H2↑+Cl2↑+2OH-
难度: 困难查看答案及解析
-
向等物质的量浓度的NaOH和Na2CO3的混合溶液中加入稀盐酸。下列离子方程式与事实不相符的是
A.OH―+CO32―+2H+→HCO3―+H2O
B.2OH―+CO32―+3H+→HCO3―+2H2O
C.2OH―+CO32―+4H+→CO2↑+3H2O
D.OH―+CO32―+3H+→CO2↑+2H2O
难度: 中等查看答案及解析
-
右表是元素周期表的一部分,X、Y、Z、W均为短周期元素,下列说法不正确的是
X
Y
Z
W
A.原子半径:Z>X>Y
B.若Z的最高价氧化物遇Y的氢化物溶液混合后有气体放出,则W的氢化物不稳定
C.若Y、W的质子数之和为23,则Z能形成碱性氧化物
D.若X能形成两种常见液态化合物,则W单质的溶液有漂白性
难度: 中等查看答案及解析
-
向一定量的Fe﹑FeO﹑Fe2O3的混合物中,加入100mL1mol/L的盐酸恰好使混合物完全溶解,放出224mL(标准状况)的气体,所得溶液中加入KSCN溶液,无血红色出现.则混合物中铁元素质量分数为
A.81.4% B.77.8% C.68.6% D.无法确定
难度: 困难查看答案及解析
-
在100mL密度为1.2g/mL稀硝酸中,加入一定量的镁和铜组成的混合物,充分反应后金属完全溶解(假设还原产物只有NO),向反应后溶液中加入3mol/L NaOH溶液至沉淀完全,测得生成沉淀质量比原金属质量增加5.1g。则下列叙述不正确是
A.当金属全部溶解时收集到NO气体的体积为2.24L(标准状况)
B.当生成沉淀的量最多时,消耗NaOH溶液体积最小为100mL
C.原稀硝酸的物质的量浓度一定为4 mol/L
D.参加反应金属总质量(m)为9.6g>m>3.6g
难度: 困难查看答案及解析
-
用碳棒电极电解一定质量的某浓度的氯化钾溶液,一段时间后停止电解。此时若加入100g 36.5%的浓盐酸,所得溶液正好与原溶液完全相同,则电解过程中转移电子的物质的量约为
A.9 mol B.7 mol C.6 mol D.8 mol
难度: 中等查看答案及解析
-
用惰性电极电解2L0.5mol/L的硝酸银溶液,当在电路中通过0.1mol电子后,调换正负极,电路中又通过了0.2mol电子,此时溶液pH值为(假设溶液体积不变)是
A.1 B.2 C.3 D.无法确定
难度: 中等查看答案及解析
-
利用图示装置进行有关实验,其中能达到实验目的或得出正确结论的是
选项
①
②
③
④
实验目的或结论
装置
A
浓盐酸
MnO2
干燥红色布条
NaOH溶液
干燥布条不褪色

B
浓硫酸
NaCl粉末
空气
NaOH溶液
制备收集HCl
C
浓硝酸
木炭
空气
NaOH溶液
浓硝酸具有氧化性
D
浓氨水
NaOH固体
空气
水
制备收集氨气
难度: 中等查看答案及解析
-
下列图示与对应叙述相符合的是
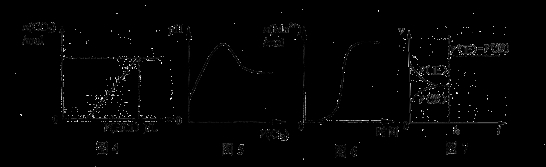
A.图4表示在含等物质的量NaOH、Na2CO3的混合溶液中滴加0.1mol·L-1盐酸至过量时,产生气体的体积与消耗盐酸的关系
B.图5表示Cl2通入H2S溶液中pH的变化
C.图6表示10 mL 0.01 mol·L-1KMnO4 酸性溶液与过量的0.1 mol·L-1 H2C2O4
溶液混合时,n(Mn2+) 随时间的变化(Mn2+对该反应有催化作用)
D.图7表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂
难度: 困难查看答案及解析
-
利用如下图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产。下列说法中正确的是

A.氯碱工业中,X、Y均为石墨,X附近能得到氢氧化钠
B.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4
C.电镀工业中,X是待镀金属,Y是镀层金属
D.外加电流的阴极保护法中,Y是待保护金属
难度: 中等查看答案及解析
-
如图是CO2电催化还原为CH4的工作原理示意图。下列说法不正确的是
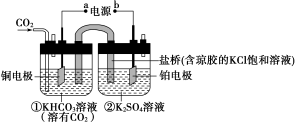
A.该过程是电能转化为化学能的过程
B.一段时间后,①池中n(KHCO3)不变
C.一段时间后,②池中溶液的pH一定下降
D.铜电极的电极反应式为CO2+8H++8e-===CH4+2H2O
难度: 困难查看答案及解析
-
全钒液流电池是一种新型的绿色环保储能电池。其电池总反应为:
V3++ VO2++H2O
VO2++2H++V2+ 下列说法正确的是
A.放电时每转移2mol电子时,消耗1mol氧化剂
B.放电时正极反应为:VO+2+2H++e—=VO2++H2O
C.放电过程中电子由负极经外电路移向正极,再由正极经电解质溶液移向负极
D.充电过程中,H+由阴极区移向阳极区迁移
难度: 中等查看答案及解析
-
第三代混合动力车,可以用电动机、内燃机或二者结合推动车辆。汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在刹车或下坡时,电池处于充电状态。其电路工作原理如图所示。下列说法中正确的的是
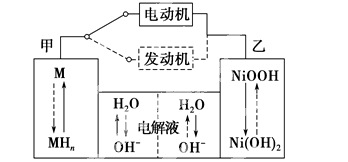
A.甲放电时为正极,充电时为阳极
B.电池充电时,OH-由甲侧向乙侧移动
C.放电时负极的电极反应式为MHn-ne- = M+nH+
D.汽车下坡时发生图中实线所示的过程
难度: 困难查看答案及解析