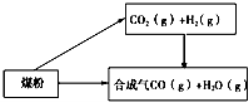
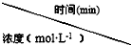-
化学在生产和日常生活中有着重要的作用。下列有关说法正确的是
A.二氧化硫有漂白性,常用作棉、麻、纸张和食品的漂白
B.氢氧化铁溶胶、水玻璃、淀粉溶液、PM2.5微粒均具有丁达尔效应
C.“地沟油”经过加工处理后,可以用来制肥皂和生物柴油
D.汽车尾气污染物中含有氮的氧化物,是汽油不完全燃烧造成的
难度: 中等查看答案及解析
-
下列实验事实所得出的相应结论正确的是
实验事实
实验结论
①
将木炭和浓硫酸反应生成的气体通入澄清石灰水中,有白色沉淀生成
该气体一定是CO2
②
燃烧的镁条放入二氧化碳中能继续燃烧
还原性:Mg>C
③
向某溶液中加入盐酸酸化的硝酸钡溶液,有白色沉淀生成
该溶液中一定含有SO42-
④
某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝
该溶液中一定有NH4+
A.①② B.③④ C.②④ D.①③
难度: 中等查看答案及解析
-
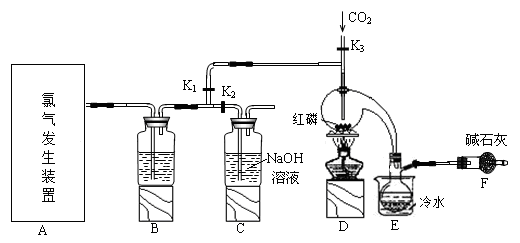
用下列实验装置和方法进行相应实验,能达到实验目的的是
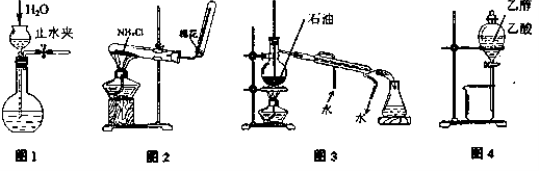
A.用图1所示方法检查装置的气密性
B.用图2所示装置和方法制取氨气
C.用图3所示装置和方法进行石油分馏
D.用图4装置和方法分离乙醇与乙酸
难度: 中等查看答案及解析
-
下列说法正确的是
A.分子式C7H16的烃,分子中有4个甲基的同分异构体有4种(不考虑立体异构)
B.
 的名称为:2,2,4﹣三甲基﹣4﹣戊烯
的名称为:2,2,4﹣三甲基﹣4﹣戊烯C.化合物
是苯的同系物
D.植物油的主要成分是不饱和高级脂肪酸
难度: 中等查看答案及解析
-
化合物M结构如图所示,对化合物M的叙述错误的是

A.M的分子式为C12H10O5
B.M可与溴水反应
C.1mol M最多可和6mol H2发生反应
D.M可发生水解反应
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值,下列叙述中正确的是
A.25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH数目为0.2NA
B.100mL 2 mol/L的NaCl溶液中含NaCl分子数为0.2NA
C.常温下,23gNO2和N2O4的混合气体中含有的氮原子数为0.5 NA
D.标准状况下,22.4L过氧化氢中含有的氧原子数为2NA
难度: 中等查看答案及解析
-
下列说法中正确的是
① 钠在空气中燃烧生成淡黄色的Na2O2;
② 常温下铝制容器可储运浓硫酸或浓硝酸;
③ 盐酸既有氧化性又有还原性;
④ Fe(OH)3、FeCl2、H2SiO3都不能直接用化合反应制备;
⑤ SO2能使酸性高锰酸钾溶液褪色,所以它具有漂白性
A.②③ B.①②③ C.①②③④ D.①②③⑤
难度: 中等查看答案及解析
-
在下列指定条件的溶液中,一定能大量共存的离子组是
①K2S溶液中:SO42﹣、K+、Cl﹣、Cu2+
②水电离的c(H+)水=1.0×10﹣13mol·L﹣1的溶液中:AlO2﹣、K+、SO42﹣、Br﹣
③pH=1的溶液中:K+、Fe2+、I﹣、Br﹣
④与铝反应产生大量氢气的溶液中:Na+、K+、NH4+、NO3﹣
⑤无色溶液中:Fe2+、Na+、ClO﹣、Cl﹣
⑥能使pH试纸呈红色的溶液中:Na+、NH4+、I﹣、NO3﹣
⑦滴入KSCN溶液显血红色的溶液中:K+、Na+、SO42﹣、C6H5OH
⑧室温下,
=0.1mol·L﹣1的溶液中:Na+、K+、SiO32﹣、NO3﹣.
A.④⑦ B.②③④ C.③⑧ D.①⑤⑥
难度: 困难查看答案及解析
-
已知硫酸亚铁溶液中加入过氧化钠时发生反应:
4Fe2++4Na2O2+6H2O═4Fe(OH)3↓+O2↑+8Na+则下列说法正确的是
A.该反应中还原剂为Fe2+,O2、Fe(OH)3均为氧化产物
B.充分反应后可以看到白色沉淀和气体生成
C.标准状况下,每生成22.4 L O2,则有4 mol Na2O2被还原
D.若有4 mol Na2O2参加反应,则反应中共转移6NA个电子
难度: 中等查看答案及解析
-
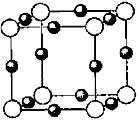
X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是
A.元素Y、Z、W形成的离子具有相同电子层结构,其离子半径依次增大
B.39g Z2Y2中含有的离子数约为1.204×1024
C.元素Z、R的氧化物的水化物之间相互反应生成的盐溶液只能呈中性或碱性
D.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR
难度: 中等查看答案及解析
-
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氢气中1 molH―H 键完全断裂时吸收热量436 kJ,水蒸气中1 mol H―O键形成时放出热量463 kJ, 则氧气中1 molO=O 键断裂时吸收热量为
A.188kJ B.248 kJ C.124kJ D.496kJ
难度: 中等查看答案及解析
-
下面提到的问题中,与盐的水解无关的正确说法是
①明矾和FeCl3可作净水剂.
②为保存FeCl3溶液,要在溶液中加少量盐酸.
③实验室配制AlCl3溶液时,应先把它溶在盐酸中,而后加水稀释.
④NH4Cl与ZnCl2溶液可作焊接中的除锈剂.
⑤实验室盛放Na2CO3、Na2SiO3等溶液的试剂瓶应用橡皮塞,而不能用玻璃塞.
⑥用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂.
⑦在NH4Cl或AlCl3溶液中加入金属镁会产生氢气.
⑧长期使用硫铵,土壤酸性增强;草木灰与铵态氮肥不能混合施用.
⑨比较NH4Cl和Na2S等溶液中离子浓度的大小或某些盐溶液的酸碱性.
A.①④⑦ B.②⑤⑧ C.③⑥⑨ D.全有关
难度: 中等查看答案及解析
-
下列说法正确的是
A.向50 mL 1 mol·L-1的盐酸中加入烧碱,水的KW不变
B.NH4Cl和NH3·H2O混合液中,二者对对方的平衡都起了抑制作用
C.有两种弱酸HX和HY且酸性HX>HY,则体积和浓度相同的NaX和NaY溶液中有c(Y-)>c(X-)>c(OH-)>c(H+)
D.常温下0.1mol·L-1的HA溶液中
,则0.01 mol·L-1HA溶液中c(H+)=1×10-4mol·L-1
难度: 困难查看答案及解析
-
如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2是溶剂,反应原理是4Li+FeS2=Fe+2Li2S。下列说法不正确的是
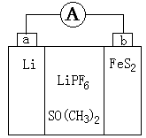
A.可以用水代替SO(CH3)2做溶剂
B.电子移动方向是由a极流向b极
C.该装置将化学能转化为电能
D.b极反应式是FeS2+4Li++4e-=Fe+2Li2S
难度: 中等查看答案及解析
-
某无色溶液中可能含有以下离子中的一种或几种:Na+、Ag+、Fe3+、NH4+、Al3+、CO32﹣、AlO2﹣、S2O32﹣、SO42﹣.现取该溶液进行有关实验,实验结果如图所示:

下列说法不正确的是
A.淡黄色沉淀甲不可能为AgBr
B.由溶液甲生成气体乙的途径只有:Al3++3HCO3﹣═Al(OH)3↓+3CO2↑
C.气体甲可能是混合气体
D.综合上述信息可以确定肯定存在的离子有:Na+、AlO2﹣、S2O32﹣
难度: 中等查看答案及解析