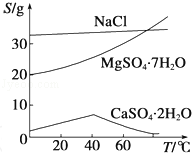
-
化学与生活、生产密切相关,下列说法正确的是
A.碳酸钡、碳酸氢钠、氢氧化铝均可作为抗酸药物使用
B.人体内的蛋白质不断分解,最终生成水和二氧化碳排出体外
C.工业生产玻璃和水泥,均需要用纯碱为原料
D.“地沟油”的主要成分是油脂,其组成与汽油、煤油不相同
难度: 简单查看答案及解析
-
下列说法正确的是
①经分析某物质只含有一种元素,则该物质一定是单质;
②根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等;
③NO2和水反应能生成硝酸,但NO2不是酸性氧化物
④溶液是电中性的,胶体是带电的
⑤不能发生丁达尔效应的分散系有氯化钠溶液、水等.
A.①③④ B.仅③ C.仅⑤ D.②③④⑤
难度: 简单查看答案及解析
-
NA代表阿伏伽德罗常数,下列叙述正确的是
A.10 mL质量分数为98%的H2SO4,用水稀释至100 mL,H2SO4的质量分数为9.8%
B.1molFe与过量的稀HNO3反应,转移的电子数为2 NA
C.标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g
D.一定温度下,l L 0.50 mol•L﹣1NH4C1溶液与2 L0.25mol•L﹣1NH4C1溶液NH4+的离子数均为0.5NA
难度: 中等查看答案及解析
-
等质量的下列物质与足量稀硝酸反应,放出NO物质的量最多的是
A.FeO B.Fe2O3 C.FeSO4 D.Fe3O4
难度: 中等查看答案及解析
-
下列有关化学概念或原理的论述中,正确的是
A.SO2、NH3的水溶液都能够导电,因此都属于电解质
B.电解饱和食盐水的过程中,水的电离平衡逆向移动
C.任何一个化学反应都可以设计为电池,输出电能
D.若两种不同的核素具有相同的中子数,则二者一定不属于同种元素
难度: 简单查看答案及解析
-
下列陈述I、II均正确且有因果关系的是
陈述I
陈述II
1
常温下铁与浓硫酸不反应
可用铁槽车密封运送浓硫酸
2
NaHCO3溶于水完全电离
NaHCO3是强电解质
3
NH4Cl为强酸弱碱盐
用加热法除去NaCl中的NH4Cl
4
H2O2、SO2能使酸性KMnO4溶液褪色
H2O2表现还原性,SO2表现漂白性
A.1 B.2 C.3 D.4
难度: 简单查看答案及解析
-
下列有关溶液组成的描述合理的是
A.由水电离出的c(H+)=10﹣13mol•L﹣1的溶液中可能存在:HCO3﹣、K+、Na+、Cl﹣
B.酸性溶液中可能大量存在Na+、ClO﹣、SO42﹣、I﹣
C.含有0.1 mol•L﹣1 Fe3+的溶液中可以大量存在:K+、Mg2+、I﹣、NO3﹣
D.室温下,pH=l的溶液中一定可以存在:Na+、Fe3+、NO3﹣、SO42﹣
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.钠与水反应:Na+2H2O=Na++2OH﹣+H2↑
B. 稀硝酸中加入过量铁粉:Fe+4H++NO3﹣=Fe3++NO↑+2H2O
C.0.01mol/LNH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合:NH4++A13++2SO42﹣+2Ba2++4OH-=2BaSO4↓+A1(OH)3↓+NH3•H2O
D.向次氯酸钙溶液通入SO2:Ca2++2ClO﹣+SO2+H2O=CaSO3↓+2HClO
难度: 中等查看答案及解析
-
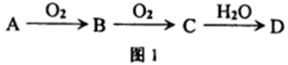
3molA和2.5molB混合于容积为2L的容器内,使它们发生反应2A(s)+3B(g)
2C(g)+D(g),经过5min生成0.5molD,下列说法正确的是
A.B的平均消耗速率为0.3mol/(L•min)
B.C的平衡浓度为2mol/L
C.平衡后,增大压强,平衡将向正方向移动
D.若反应容器内气体的密度不再发生变化,说明反应已经达到平衡
难度: 中等查看答案及解析
-
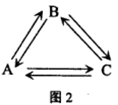
在某2L恒容密团容器中充入2mol X(g)和1mol Y(g)发生反应:2X(g)+Y(g)
3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示:下列推断正确的是
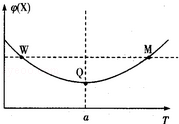
A.升高温度,平衡常数增大
B.W点Y的正反应速率等于M点Y的正反应速率
C.Q点时,Y的转化率最大
D.平衡时充入Z.达到新平衡时Z的体积分数比原平衡时大
难度: 中等查看答案及解析
-
常温下,向l00mL 0.01mol•L﹣1HA溶液中逐滴加入0.02mol•L﹣1MOH溶液,如图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中,正确的是
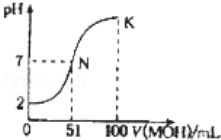
A.HA为一元强酸,MOH为一元强碱
B.K点所示溶液中c(A﹣)>c(M+)
C.N点水的电离程度小于K点水的电离程度
D.K点溶液的pH=10,则有c(MOH)+c(OH﹣)﹣c(H+)=0.005mol•L﹣1
难度: 困难查看答案及解析
-
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br﹣、2Fe3++2I﹣═2Fe2++I2,则下列有关说法中不正确的是
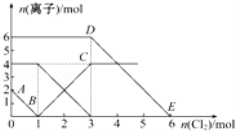
A.还原性:I﹣>Fe2+>Br﹣
B.线段AB表示Fe2+被氯气氧化
C.线段BC表示生成4 mol Fe3+
D.原溶液中n(Br﹣)=6 mol
难度: 困难查看答案及解析
-
下列实验操作正确的是
A.中和滴定实验时,用待测液润洗锥形瓶
B.盛放Na2SiO3溶液时,使用带玻璃塞的磨口瓶
C.用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出
D.NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热
难度: 中等查看答案及解析
-
下列实验现象预测或装置的选用正确的是
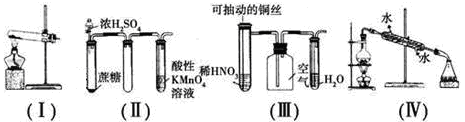
A.用装置(Ⅰ)加热草酸晶体的方法获取某些气体(草酸晶体的熔点101.5℃,分解温度约为150℃)
B.用装置(Ⅱ)进行实验时,酸性KMnO4溶液中出现气泡,且颜色逐渐褪去
C.用装置(Ⅲ)进行实验时,广口瓶内先有浅红棕色气体出现后又变为无色,且不会产空气污染
D.用装置(Ⅳ)分离溴苯和苯的混合物
难度: 中等查看答案及解析
-
硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示),下列说法错误的是
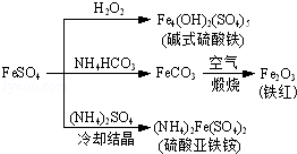
A.碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D.常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
难度: 困难查看答案及解析
-
用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中不正确的是
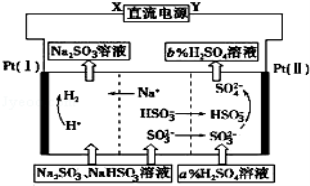
A.X为直流电源的负极,Y为直流电源的正极
B.阳极区pH增大
C.图中的b>a
D.该过程中的产品还有H2SO4
难度: 中等查看答案及解析