-
化学与生活、生产密切相关,下列说法错误的是
A. 江河入海口三角洲的形成与胶体性质有关
B. “柴油树”的树油用于生产生物柴油,可作柴油使用
C. 废旧电池应集中处理主要是要回收其中的金属材料
D. 将二氧化硫添加于红酒中可以起到杀菌和抗氧化作用
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A. 标准状况下,向2.24L密闭容器中充满NO2气体,其所含分子数为0.1 NA
B. CuO和Cu2S的混合物80 g中,所含铜粒子数为2NA
C. 常温常压下,22gT2O含中子数为12NA
D. 1.0 L 1.0 mol·L-1的NaNO3水溶液中含有的氧原子数为3NA
难度: 中等查看答案及解析
-
三氯异氰尿酸是一种极强的氧化剂和氯化剂,利用氰尿酸(图1)与次氯酸在一定pH下反应可制备三氯异氰尿酸(图2),若原料完全反应生成三氯异氰尿酸,下列说法正确的是
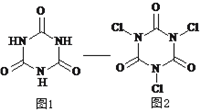
A. 氰尿酸的分子式为C6N3O3H3
B. HClO的电子式为
C. 该转化过程有机物发生还原反应
D. 氰尿酸和次氯酸反应的物质的量之比为2 : 3
难度: 中等查看答案及解析
-
连二亚硫酸钠(Na2S2O4)俗称保险粉,易被氧气氧化。利用如图装置,在锥形瓶中加入HCOONa、NaOH、CH3OH和水形成的混合液,通入SO2时发生反应生成保险粉和一种常见气体,下列说法错误的是
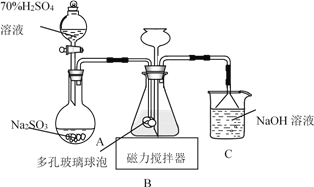
A. 制备保险粉的离子方程式为HCOO-+OH-+2SO2===S2O42-+CO2↑+H2O
B. NaOH溶液的主要作用是吸收逸出的CO2
C. 多孔玻璃球泡的作用是增大气体与溶液的接触面积,使SO2能被充分吸收
D. 为避免产生的Na2S2O4被O2氧化,使硫酸与亚硫酸钠先反应,产生的SO2排出装置中残留的O2
难度: 中等查看答案及解析
-
近几年,具有超常性能的铝离子电池成为研究热点,其可在一分钟内完成充放电。铝与石墨为电极,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示。下列说法错误的是
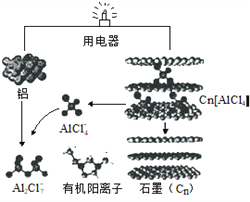
A. 放电时,有机阳离子向石墨电极方向移动
B. 放电时,正极的电极反应式为:Cn[AlCl4]+e-=Cn+AlCl4-
C. 充电时,每生成1mol铝,同时消耗4molAl2Cl7-
D. 充电时铝电极接电源负极,该极有Cn[AlCl4]生成
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增加。A是元素Y的单质。常温下,甲的浓溶液和A发生钝化。丙、丁、戊是由这些元素组成的二元化合物,且丙是无色气体。上述物质的转化关系如图所示。下列说法正确的是
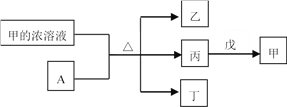
A. 丁和戊中所含元素种类相同
B. 简单离子半径大小:X<Y
C. 气态氢化物的还原性:X>Z
D. Y的简单离子与Z的简单离子在水溶液中可大量共存
难度: 中等查看答案及解析
-
砷(As)是一些工厂和矿山废水中的污染元素。常温下,H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与加NaOH溶液调节pH的关系如图所示(已知:pKa=-lgKa),下列说法错误的是
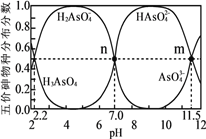
A. Na2HAsO4溶液显碱性
B. H3AsO4溶液pKa2为2.2
C. m点对应溶液中由水电离出的c(OH-)为10-2.5mol·L-1
D. n点对应溶液中离子浓度关系为:c(Na+)>c(HAsO42-)=c(H2AsO4-)>c(H+)=c(OH-)
难度: 中等查看答案及解析
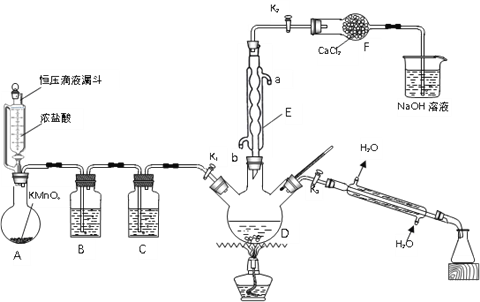
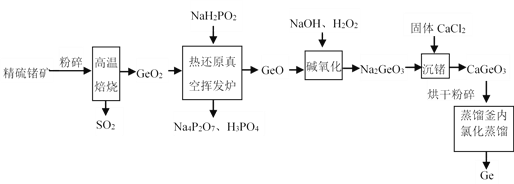
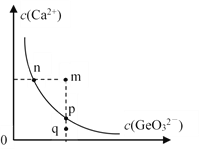

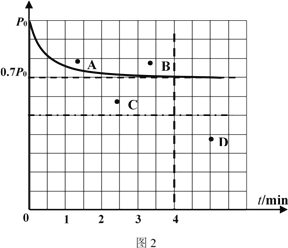
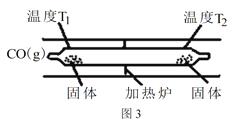
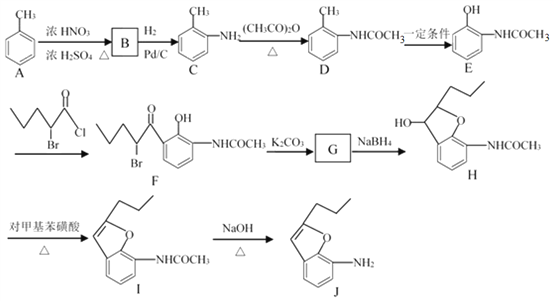
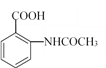 ,参照上述合成过程,写出相应的合成路线流程图(无机试剂任选)_________。
,参照上述合成过程,写出相应的合成路线流程图(无机试剂任选)_________。