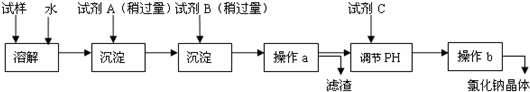
-
下列措施不能达到节能减排目的是( )
A.利用太阳能制氢燃料
B.用家用汽车代替公交车
C.利用潮汐能发电
D.用节能灯代替白炽灯难度: 中等查看答案及解析
-
元素组成物质,下列说法不正确的是( )
A.构成地壳基本骨架的非金属元素的是O、Si
B.蛋白质中均含C、H、O、N四种元素
C.海水中的钠元素经过物理变化就可形成钠单质
D.火山喷发形成的物质中通常含有硫元素难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.应用盖斯定律,可计算某些难以直接测量的反应焓变
B.化学键的断裂与形成是化学反应中能量变化的主要原因
C.反应物能量高于生成物能量的反应是吸热反应
D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件的△H相同难度: 中等查看答案及解析
-
化学可以帮助人们形成对物质的科学认识,下列说法正确的是( )
A.富含蛋白质的食物多属于酸性食物
B.有甜味的物质都是糖类物质
C.蚕丝、羊毛和淀粉分别属于纤维素、蛋白质和多糖
D.水晶、陶瓷、玻璃的主要成分都是硅酸盐难度: 中等查看答案及解析
-
同位素2H、15N、18O、34S等常被用做陆地生态分析研究.下列说法中正确的是( )
A.16O和18O是同一种核素
B.1H218O的摩尔质量为20
C.34S和15N核内的中子数相差9
D.2H+核外电子数为0难度: 中等查看答案及解析
-
对H2O的电离平衡不产生影响的粒子是( )
A.
B.13M3+
C.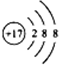
D.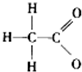
难度: 中等查看答案及解析
-
在生活中化学物质有广泛的应用,下列物质的用途不正确的是( )
A.维生素C具有还原性,在体内可起抗氧化作用
B.可用某些铝盐、铁盐由海水制淡水
C.硅酸钠溶液可用做木材的防火剂
D.生石灰和铁粉可分别用于食品防潮和防氧化变质难度: 中等查看答案及解析
-
用下列实验装置完成对应的实验(部分仪器略去),能达到实验目的是:( )
A.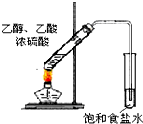
制取乙酸乙酯
B.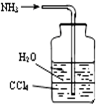
吸收NH3
C.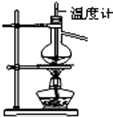
石油的分馏
D.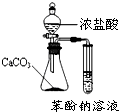
比较盐酸、碳酸、苯酚的酸性强弱难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.淀粉碘化钾试纸上滴稀硝酸变蓝:2I-+4H++NO3-=I2+NO↑+2H2O
B.用醋酸除去水垢:CaCO3+2H+=Ca2++H2O+CO2↑
C.向Mg(OH)2悬浊液中加入FeCl3溶液:3Mg(OH)2+2Fe3+⇌2Fe(OH)3+3Mg2+
D.向氯化铝溶液中滴加过量的氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.7.1 g Cl2与足量NaOH溶液反应转移0.2×6.02×1023个电子
B.1mol羟基中含有的电子数目为9×6.02×1023个
C.标准状况下,2.24 L辛烷含有0.6×6.02×1023个碳原子
D.1 L 0.50 mol/LNa2CO3溶液中含有1.5×6.02×1023个离子难度: 中等查看答案及解析
-
某溶液中由水电离出的c(H+)=10-12mol/L,能在该溶液中大量共存的一组离子是( )
A.NH4+、Ag+、PO43-、Cl-
B.K+、Na+、NO3-、MnO4-
C.Fe3+、H+、I-、HCO3-
D.Al3+、Mg2+、SO42-、CO32-难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z在元素周期表中的位置如图所示,若Z元素的单质是可用于制造太阳能电池的半导体材料.下列说法中,正确的是( )
A.Y、Z的最高价氧化物均能与氢氧化钠溶液发生反应
B.同周期中Z的最高价氧化物对应的水化物酸性最强
C.X原子在四种元素中原子半径最大
D.W的气态氢化物在同主族元素中稳定性最差难度: 中等查看答案及解析
-
下列说法正确的是( )
A.苯乙烯分子中所有原子可能在一个平面上
B.分子式为C7H8O且分子中有苯环的有机物共有4种
C.的名称为2-甲基-3-丁烯
D.顺-2-丁烯和反-2-丁烯的加氢产物不同难度: 中等查看答案及解析
-
某温度下,容积一定的密闭容器中进行如下可逆反应:X(g)+Y(g)⇌2Z(g)+W(s)△H>0,下列叙述正确的是( )
A.加入少量W,逆反应速率增大
B.当容器中气体压强不变时,反应达到平衡
C.使用高效催化剂,X的转化率增大
D.升高温度,平衡正向移动难度: 中等查看答案及解析
-
100℃时,KCl溶液中溶质的物质的量浓度为C1.降至室温后析出m g KCl晶体(晶体中不含结晶水),所得溶液中溶质的物质的量浓度为C2,则下列说法不正确的是( )
A.一定条件下,KCl的溶解度是有限的
B.溶液中KCl的物质的量浓度C1一定大于C2
C.降温前后,溶液中KCl的物质的量未发生改变
D.降温过程中,结晶和溶解的速率可能出现相等难度: 中等查看答案及解析
-
下列叙述合理的是(以下操作均在25℃时进行)( )
A.pH=1的盐酸和硫酸,溶液中c(H+)之比为1:1
B.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
C.0.2 mol•L-1盐酸与等体积0.05 mol•L-1Ba(OH)2溶液混合后,溶液pH为1
D.使用广泛pH试纸测量CH3COONa溶液的pH=9.6难度: 中等查看答案及解析
-
中药狼把草的成分之一M具有清炎杀菌作用,M的结构如图所示.下列叙述正确的是( )
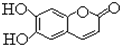
A.M属于苯的同系物,可使KMnO4溶液褪色
B.1 mol M最多能与2mol Br2发生反应
C.1 mol M与足量的NaOH溶液发生反应时,可以消耗NaOH 4mol
D.1mol M与足量NaHCO3反应能生成2 mol CO2难度: 中等查看答案及解析
-
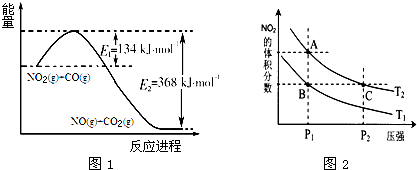
已知:Fe2O3(s)+
C(s)=
CO2(g)+2Fe(s)△H=234.1kJ•mol-1
C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
则2Fe(s)+O2(g)=Fe2O3(s)的△H是( )
A.-824.4kJ•mol-
B.-627.6kJ•mol-1
C.-744.7kJ•mol-1
D.-169.4kJ•mol-1难度: 中等查看答案及解析
-
下述实验能达到预期目的是( )
实验内容 实验目的 A 向盛有25ml沸水的烧杯中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸,至溶液呈红褐色 制备Fe(OH)3胶体 B 将SO2通入棕黄色溴水中,溶液褪色 证明SO2具有漂白性 C 淀粉溶液和稀硫酸混合加热后,加新制的Cu(OH)2悬浊液加热至沸腾 检验淀粉水解是否完全 D 向某无色溶液加入盐酸酸化的BaCl2溶液观察到有白色沉淀产生 检验溶液中是否存在SO42-
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
X、Y、Z、W有如右图所示的转化关系,则X、Y可能是( )
①N2、NO、NO2
②AlCl3、Al(OH)3、NaAlO2
③S、SO2、SO3
④NaOH、Na2CO3、NaHCO3.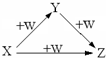
A.①②③④
B.①②
C.②④
D.③④难度: 中等查看答案及解析
-
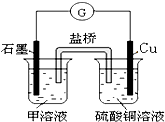
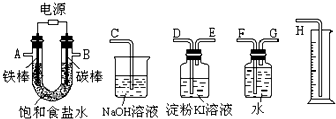
用碱性氢氧燃料电池为电源进行电解的实验装置示意图如图所示.下列说法中正确的是( )

A.燃料电池工作时负极反应为:H2=2H++2e-
B.若要实现铁上镀铜,则a极是铁,b极是铜
C.若要实现电解精炼粗铜,则a极发生氧化反应,b极上有铜析出
D.a、b两极均是石墨时,在相同条件下当电池中消耗H222.4L(标准状况)时,a极析出铜64g难度: 中等查看答案及解析
-
下列关于电解质溶液的叙述正确的是( )
A.同浓度、同体积的氨水与硫酸混合反应后,则c(NH4+)+c(H+)=c(SO42-)+c(OH-)
B.常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH4+)>c(H+)=c(OH-)
C.常温下,同浓度的Na2CO3与NaHCO3溶液相比,Na2CO3溶液的pH大
D.将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低难度: 中等查看答案及解析