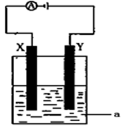
-
下列关于弱电解质的说法中,正确的是
A.弱电解质需要通电才能发生电离
B.醋酸达到电离平衡时,不存在:CH3COO-+H+
CH3COOH
C.H2SO4是共价化合物,所以它是弱电解质
D.电离平衡右移,电解质分子的浓度不一定减小
难度: 中等查看答案及解析
-
下列说法正确的是
A.电离常数受溶液、浓度的影响
B.电离常数可以表示弱电解质的相对强弱
C.电离常数大的酸中的c(H+)一定比电离常数小的酸中的c(H+)大
D.H2CO3的电离常数表达式:K=
难度: 中等查看答案及解析
-
一定温度下,向0.1 mol·L-1 CH3COOH溶液中加少量水,下列有关该溶液说法错误的是
A.溶液中所有离子的浓度都减小 B.CH3COOH的电离程度变大
C.水的电离程度变大 D.溶液的pH增大
难度: 中等查看答案及解析
-
下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是
选项
A
B
C
D
强电解质
CaCO3
NaCl
HI
HNO3
弱电解质
CH3COONH4
NH3
H3PO4
Fe(OH)3
非电解质
蔗糖
BaSO4
酒精
H2O
难度: 中等查看答案及解析
-
升高温度,下列数据不一定增大的是
A.化学反应速率v B.电离常数K电离
C.化学平衡常数K D.水的离子积常数KW
难度: 中等查看答案及解析
-
常温时,0.01 mol·L-1某一元弱酸的电离常数Ka=10-6,则下列说法正确的是
A.上述弱酸溶液的pH=4
B.加入NaOH溶液后,弱酸的电离平衡向右移动,K值增大
C.加入等体积0.01 mol·L-1 NaOH溶液后,所得溶液的pH=7
D.加入等体积0.01 mol·L-1 NaOH溶液后,所得溶液的pH<7
难度: 中等查看答案及解析
-
相同温度下,根据三种酸的电离常数,下列判断正确的是
酸
HX
HY
HZ
电离常数K
9×10-7
9×10-6
10-2
A.三种酸的强弱关系:HX>HY>HZ
B.反应HZ+Y-===HY+Z-能够发生
C.相同温度下,0.1 mol·L-1的HX、HY、HZ溶液,HX与锌反应一定最快
D.相同温度下,1 mol·L-1 HX溶液的电离常数大于0.1 mol·L-1 HX
难度: 中等查看答案及解析
-
已知0.1mol·L-1的醋酸溶液中存在电离平衡:CH3COOH
CH3COO-+H+,要使溶液中
的值增大,可以采取的措施是
①加少量烧碱溶液 ②升高温度 ③加少量冰醋酸 ④加水
A.①② B.①③ C.②④ D.③④
难度: 中等查看答案及解析
-
一元弱酸HA溶液中存在下列电离平衡:HA
H++A-。将1.0 mol HA分子加入水中配成1.0 L溶液,下图表示溶液中HA、H+、A-的物质的量浓度随时间变化的曲线正确的是

难度: 中等查看答案及解析
-
用水稀释0.1 mol·L-1氨水,溶液中随着水量的增加而增大的是
A.c(H+)·c(NH3·H2O)/c(NH4+) B.c(NH4+)·c(OH-)/c(NH3·H2O)
C.
D.c(H+)·c(OH-)
难度: 中等查看答案及解析
-
某溶液中在25℃时由水电离出的氢离子浓度为1×10-12mol/L,下列说法正确的是
A.HCO3-离子在该溶液中一定不能大量共存
B.该溶液的pH一定是12
C.向该溶液中加入铝片后,一定能生成氢气
D.若该溶液的溶质只有一种,它一定是酸或碱
难度: 中等查看答案及解析
-
常温下MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示。下列叙述中不正确的是
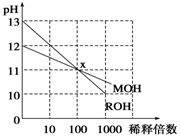
A.ROH是一种强碱,MOH是一种弱碱
B.在x点,c(M+)=c(R+)
C.稀释前,c(ROH)<10c(MOH)
D.稀释前,c(ROH)= 10c(MOH)
难度: 中等查看答案及解析
-
硼酸(H3BO3)溶液中存在如下反应:H3BO3(aq)+H2O(l)
[B(OH)4]-(aq)+H+(aq)。下列说法正确的是
化学式
电离常数(298 K)
硼酸
K=5.7×10-10
碳酸
K1=4.4×10-7 K2=4.7×10-11
醋酸
K=1.75×10-5
A.将一滴碳酸钠溶液滴入硼酸溶液中一定能观察到有气泡产生
B.将一滴醋酸溶液滴入碳酸钠溶液中一定能观察到有气泡产生
C.等物质的量浓度的碳酸溶液和硼酸溶液比较,pH:前者>后者
D.等物质的量浓度的碳酸溶液和醋酸溶液比较,pH:前者>后者
难度: 中等查看答案及解析
-
分别在pH=1的酸和pH=14的NaOH溶液中加入足量的铝,放出H2的量前者多,其原因可能是
①两溶液的体积相同,酸是多元强酸 ②两溶液的体积相同,酸是一元弱酸 ③酸溶液的体积大于NaOH溶液的体积 ④酸是强酸,浓度比NaOH溶液的大
A.①② B.② C.②③ D.④
难度: 中等查看答案及解析
-
在某温度时,pH=3的某水溶液中c(OH-)=10-9 mol·L-1,现有该温度下的四份溶液:①pH=2的CH3COOH;②0.01 mol·L-1的HCl;③pH=11的氨水;④pH=11的NaOH溶液。下列说法正确的是
A.①中水的电离程度最小,③中水的电离程度最大
B.若将②与④按照10∶1的体积比混合,混合溶液的pH﹤7
C.将四份溶液稀释相同倍数后,溶液的pH:③>④>②>①
D.将四份溶液稀释相同倍数后,溶液的pH:④>③>①>②
难度: 中等查看答案及解析
-
在25 ℃时,向V mL pH=m的HNO3中滴加pH=n的KOH溶液10V mL时,溶液中NO的物质的量恰好等于加入的K+的物质的量,则m+n的值为
A.13 B.14 C.15 D.不能确定
难度: 中等查看答案及解析
-
25℃时,Kw=1.0×10﹣14;100℃时,Kw=5.5×10﹣13.下列说法正确的是
A.100℃时,pH=12的NaOH溶液和pH=2的H2SO4恰好中和,所得溶液的pH=7
B.25℃时,0.2 mol/L Ba(OH)2溶液和0.2 mol/L HCl等体积混合,所得溶液的pH=7
C.25℃时,0.2 mol/L NaOH溶液与0.2 mol/L CH3COOH恰好中和,所得溶液的pH=7
D.25℃时,pH=12的氨水和pH=2的H2SO4等体积混合,所得溶液的pH>7
难度: 中等查看答案及解析
-
关于下列各装置图的叙述中,正确的是
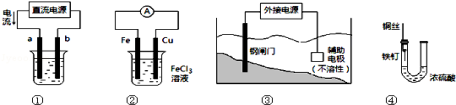
A.用装置①精炼铜,则b极为粗铜,电解质溶液为CuSO4溶液
B.装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+
C.装置③中钢闸门应与外接电源的正极相连
D.装置④中的铁钉几乎没被腐蚀
难度: 中等查看答案及解析
-
下列操作,妥当的是
A.用托盘天平称量氢氧化钠固体时,需在左、右托盘上各放一块质量相等的滤纸
B.用25 mL滴定管量取25 mL的氢氧化钠溶液时,需将调好零点的滴定管内所有液体放出
C.用25 mL滴定管量取10 mL氢氧化钠溶液时,下端玻璃导管尖嘴悬挂的液滴不需处理
D.用量筒量取一定量体积的液体配制一定物质的量浓度的溶液时,不需把蒸馏水洗涤量筒后的洗涤液移入容量瓶
难度: 中等查看答案及解析
-
如图曲线a和b是盐酸与氢氧化钠相互滴定的滴定曲线,下列叙述正确的是
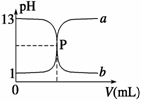
A.盐酸的物质的量浓度为1 mol·L-1
B.P点时恰好完全反应,溶液呈中性
C.曲线a是盐酸滴定氢氧化钠的滴定曲线
D.酚酞不能用作本实验的指示剂
难度: 中等查看答案及解析
-
中和滴定是一种操作简单、准确度高的定量分析方法。实际工作中也可利用物质间的氧化还原反应、沉淀反应进行类似的滴定分析,这些滴定分析均需要通过指示剂来确定滴定终点,下列对几种具体的滴定分析(待测液置于锥形瓶内)中所用指示剂及滴定终点时的溶液颜色的判断不正确的是
A.用标准酸性KMnO4溶液滴定Na2SO3溶液以测定其浓度:KMnO4——紫红色
B.利用“Ag++SCN-===AgSCN↓”原理,可用标准KSCN溶液测定AgNO3溶液浓度:Fe(SCN)3——红色
C.利用“2Fe3++2I-===I2+2Fe2+”,用FeCl3溶液测量KI样品中KI的百分含量:淀粉——蓝色
D.利用OH-+H+===H2O来测量某盐酸的浓度时:酚酞——浅红色
难度: 中等查看答案及解析
-
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是

A.正极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从负极区移向正极区
D.电池总反应为C6H12O6+6O2=6CO2+6H2O
难度: 中等查看答案及解析
-
在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法正确的是
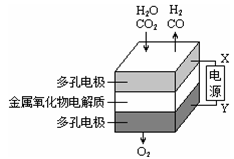
A.X是电源的正极
B.阴极的反应式是:H2O+2eˉ=H2+O2ˉ、CO2+2eˉ=CO+O2ˉ
C.总反应可表示为:H2O+CO2
H2+CO
D.阴、阳两极生成的气体的物质的量之比是1︰1
难度: 中等查看答案及解析
-
用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定)。欲使溶液恢复到起始状态,可向溶液中加入

A.0.15 mol CuO B.0.05 mol Cu2(OH)2CO3
C.0.075mol Cu(OH)2 D.0.1 mol CuCO3
难度: 中等查看答案及解析