-
天津是我国研发和生产锂离子电池的重要基地。锂离子电池正极材料是含锂的二氧化钻(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示。电池反应为
,下列说法正确的是( )
A.充电时,电池的负极反应为LiC6-e-=Li+C6
B.放电时,电池的正极反应为CoO2+Li++e-=LiCoO2
C.羧酸、醇等含活泼氢气的有机物可用作锂离子电池的电解质
D.锂离子电池的比能量(单位质量释放的能量)低
难度: 困难查看答案及解析
-
在一定条件下,对于在密闭容器中进行的反应P(g)+Q(g)
R(g)+S(g),下列说法中可以充分说明这一反应已经达到平衡状态的是
A.P、Q、R、S的浓度相等 B.P、Q、R、S在容器中共存
C.P、Q、R、S的浓度不再变化 D.P、Q的消耗速率相等
难度: 中等查看答案及解析
-
有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池。电池的总反应类似于CH4在O2中燃烧,则下列说法不正确的是 ( )
①在标准状况下,每消耗5.6L CH4可以向外电路提供2mole-
②通过甲烷电极的电极反应式为:CH4+10OH--8e-=CO32-+7H2O
③通过甲烷的电极为电池的正极,通过氧气的电极为负极
④电池放电后,溶液PH不断升高
A.①② B.①③ C.①④ D.③④
难度: 中等查看答案及解析
-
向MgCl2、AlCl3的混合溶液开始滴加6mol/L的试剂A,之后改滴试剂B,所得沉淀物质的量Y(mol)与试剂体积V(mL)间的关系如图所示。以下结论不正确的是( )
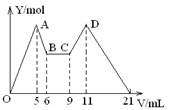
A.从6到9,相应离子反应方程式为H++OH-=H2O
B.A 是NaOH,B是盐酸,且c(NaOH):c( HCl) = 2:1
C.原混合液中,c(Al3+):c(Mg2+):c(Cl-) = 1:1:5
D.A是盐酸,B是NaOH, 且c(NaOH) =" 2c" (HCl)
难度: 中等查看答案及解析
-
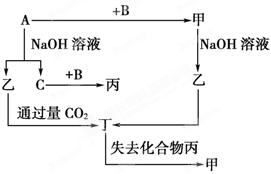
如图所示,6个编号分别代表下列物质中的一种物质,凡是用直线相连的两种物质均能发生化学反应(已知高温下氨能还原氧化铁):
a. Al b.Fe2O3 c.NaOH溶液 d. HI溶液 e.NH3 f.Cl2
图中⑤表示的物质是( )
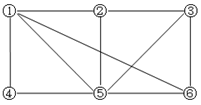
A.a或b B.c C.d D.e或f
难度: 困难查看答案及解析
-
已知Ba[Al(OH)4]2可溶于水。右图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系。下列有关叙述正确的是
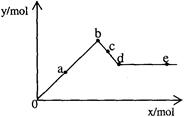
A a-b时沉淀的物质的量:A1(OH)3比BaSO4多
B d-e时溶液中离子的物质的量:Ba2+可能等于OH-
C a-d时沉淀的物质的量:BaSO4可能小于A1(OH)3
D c-d时溶液中离子的物质的量:[Al(OH)4]-比Ba2+少
难度: 困难查看答案及解析
-
已知短周期元素的离子aA2+、bB+、cC3–、dD–都具有相同的电子层结构,则下列叙述正确的是( )
A.原子半径:r(A)>r(B)>r(D)>r(C) B.原子序数:b>a>c>d
C.离子半径:r(C3–)>r(D–)>r(B+)>r(A2+) D.元素的金属性:A>B>D>C
难度: 困难查看答案及解析
-
下表给出了X、Y、Z、W四种短周期元素的部分信息,请根据这些信息判断下列说法中正确的是 ( )
元素
X
Y
Z
W
原子半径(nm)
0. 102
0.130
0.073
0.071
最高正价或最低负价
+6
+2
-2
-1,W无正价
A.HW水溶液可以保存在玻璃瓶中 B.X的单质与Z的单质反应生成XZ3
C.Z的最高正价为+6 D.原子序数X>Y>W>Z
难度: 困难查看答案及解析
-
八角茴香是中国传统的香料和中药,八角茴香含有一种重要成分莽草酸,莽草酸是目前世界上被证明是对抗禽流感的唯一良方—“达菲”的原材料。莽草酸的结构简式为:下列关于莽草酸的说法正确的是
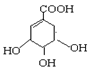
A.该化合物的分子式为C7H11O5
B.该化合物的分子处于同一平面的原子只有4个
C.该化合物可以与溴水、NaOH、NaHCO3发生反应
D.该化合物在浓硫酸作用下加热不能制备得到
难度: 困难查看答案及解析
-
具有显著抗癌活性的10-羟基喜树碱的结构如图所示,
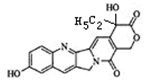
下列关于10-羟基喜树碱的说法正确的是
A.10-羟基喜树碱属于芳香烃
B.分子式为:C20H16N2O5
C.不能发生酯化反应
D.一定条件下,1mol该物质可与9molH2发生加成反应
难度: 困难查看答案及解析
-
某有机物的结构简式如右图所示,则此有机物可发生反应的类型有①取代 ②加成 ③消去 ④酯化 ⑤水解 ⑥中和 ⑦氧化 ⑧加聚,其中组合正确的是 ( )
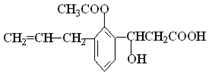
A.①②③⑤⑥ B.②③④⑤⑥
C.①②③④⑤⑥ D.全部
难度: 困难查看答案及解析
-
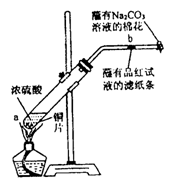
下列反应的化学方程式(或离子方程式)错误的是 ( )
A.苯酚与氢氧化钠溶液反应

B.溴乙烷与NaOH溶液混和共热CH3CH2Br + NaOH
CH2=CH2↑+H2O+NaBr
C.乙醛与银氨溶液反应 CH3CHO+2[Ag(NH3)2]OH
CH3COONH4+2Ag↓+3NH3+H2O
D.乙醇的消去反应 CH3CH2OH
CH2 =CH2 ↑+H2O
难度: 中等查看答案及解析