-
下列说法中,正确的是( )
A.冰醋酸是弱电解质,液态时能导电
B.强电解质溶液的导电能力不一定比弱电解质强
C.盐酸中加入固体NaCl,因Cl-浓度增大,所以溶液酸性减弱。
D.电解质达到电离平衡后,各种离子的浓度相等
难度: 简单查看答案及解析
-
25℃时,在某物质的溶液中,由水电离出的c(H+)=1×10-amol/L,下列说法正确的是( )
A.a<7时,水的电离受到抑制 B.a>7时,水的电离被促进了
C.a<7时,溶液的pH一定为a D.a>7时,溶液的pH一定为14-a
难度: 简单查看答案及解析
-
室温时,将pH=12的NaOH溶液与pH=2的CH3COOH溶液等体积混合后,下列关系式中正确的是( )
A.c(Na+)>c (CH3COO-)>c(OH-)>c(H+) B.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C.c(Na+)=c(CH3COO-)+c(CH3COOH) D.c(H+)=c(CH3COO-)+c(OH-)
难度: 简单查看答案及解析
-
下列说法正确的是( )
①用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小;
②物质的溶解度随温度的升高而增加,物质的溶解都是吸热的;
③对于Al(OH)3(s)
Al(OH)3(aq)
Al3++3OH-,前者为溶解平衡,后者为电离平衡;
④除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3小
⑤沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全。
A.①②③④⑤ B.② C. ①③④⑤ D.①②⑤
难度: 简单查看答案及解析
-
下表是五种银盐的溶度积常数(25℃):
化学式
AgCl
Ag2SO4
Ag2S
AgBr
AgI
溶度积
1.8×10-10
1.4×10-5
6.3×10-50
7.7×10-13
8.51×10-16
下列说法错误的是( )
A.五种物质在常温下溶解度最大的是Ag2SO4
B.将氯化银溶解于水后,向其中加入Na2S,则可以生成黑色沉淀
C.对于AgCl、AgBr和AgI三种物质在常温下的溶解度随着氯、溴、碘的顺序增大
D.沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动
难度: 简单查看答案及解析
-
向ZnSO4溶液中加入Na2S溶液时,得到白色沉淀,然后向白色沉淀中滴加CuSO4溶液,发现沉淀变为黑色,则下列说法不正确的是
A.白色沉淀为ZnS,黑色沉淀为CuS
B.上述现象说明ZnS的Ksp小于CuS的Ksp
C.利用该原理可实现一种沉淀转化为更难溶的沉淀
D.该过程破坏了ZnS的溶解平衡
难度: 简单查看答案及解析
-
已知HCN的电离常数K=6.2×10-10.用物质的量都是0.1mol的HCN和NaCN混合后配成1L溶液,经测定溶液呈碱性.则下列关系式正确的是
A.c(CN-)>c(Na+) B.c(CN-)>c(HCN)
C.c(HCN)+c(CN-)=0.2mol·L-1 D.c(CN-)+c(OH-)=0.1 mol·L-1
难度: 简单查看答案及解析
-
有一合金由X、Y、Z、W四种金属组成: ①若将合金放入盐酸中只有Y、Z能溶解②若将合金置于潮湿空气中,表面只出现Z的化合物③若将该合金作阳极,用X盐溶液作电解质溶液,通电时四种金属都以离子形式进入溶液中,但在阴极上只析出X。这四种金属的活动性顺序是 ( )
A.Y>Z>W>X B.Z>Y>W>X C.W>Z>Y>X D.X>Y>Z>W
难度: 简单查看答案及解析
-
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH(从左到右放电,从右到左充电)。下列叙述不正确的是 ( )
A.放电时锌做负极 B.充电时氢氧化铁被氧化
C.充电时电池的正极和电源的正极相连 D.放电时每转移3mole-,有2molFeO42-被还原
难度: 简单查看答案及解析
-
用两支惰性电极插入250mlCuSO4溶液中,通电电解。当电解液的pH从6.0变为2.0时(电解时阴极没有氢气放出,且电解液在前后体积变化可以忽略),则阴极增重( )
A.80mg B.160mg C.320mg D.640mg
难度: 简单查看答案及解析
-
下列防腐措施中,利用原电池反应使主要金属得到保护的是( )
A.用氧化剂使金属表面生成致密稳定的氧化物保护膜
B.在金属中加入一些铬或镍制成合金 C.在轮船的壳体水线以下部分装上锌锭
D.在地下输油的铸铁管上接直流电源的负极
难度: 简单查看答案及解析
-
某金属元素R的硝酸盐R(NO3)n溶液用Pt电极电解,阳极产生气体VL(标准状况)时,阴极质量增加mg,若R的原子量为M,下列叙述中不正确的是 ( )
难度: 简单查看答案及解析
-
下图有关电化学的示意图正确的是( )

难度: 简单查看答案及解析
-
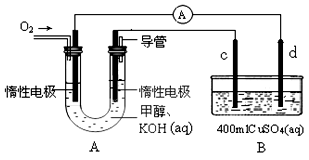
由化学能转变的热能或电能仍然是人类使用的主要能源。根据下图所示的装置,判断下列说法不正确的是

A.该装置中Pt极为阳极
B.当c极的质量变化了2.16g时,a极上消耗的O2在标准状况下的体积为1.12L
C.该装置中b极的电极反应式是:H2+2OH--2e-==2H2O
D.该装置中a极为正极,发生氧化反应
难度: 简单查看答案及解析
-
用铁丝(电极a)、铜丝(电极b)和CuSO4溶液可以构成原电池或电解池,如图所示。则下列说法正确的是

A.构成原电池时b极反应为:Cu﹣2e-=Cu2+
B.构成电解池时a极质量一定减少
C.构成电解池时b极质量可能减少也可能增加
D.构成的原电池或电解池工作后就可能产生大量气体
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A.铅蓄电池在放电过程中,负极质量减小,正极质量增加
B.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0
C.一定条件下,使用催化剂能加快反应速率但不能提高反应物的转化率
D.相同条件下,溶液中Fe3+、Cu2+、H+、Zn2+的氧化性依次减弱
难度: 简单查看答案及解析