-
下列事实能说明影响化学反应速率的主要因素是反应物自身性质的是
A. Cu与浓硝酸反应比与稀硝酸反应快
B. Cu能与浓硝酸反应,但不能与浓盐酸反应
C. N2与O2在常温、常压下不反应,放电时可反应
D. Fe与浓盐酸反应比与稀盐酸反应快
难度: 中等查看答案及解析
-
下列四个数据都表示合成氨的反应速率,其中代表同一反应的是
①v(N2)=0.3 mol·(L·min) -1②v(NH3)=0.9 mol·(L·min) -1
③v(H2)=0.6 mol·(L·min) -1④v(H2)=0.022 5 mol·(L·s) -1
A. ①② B. ①③ C. ③④ D. ②④
难度: 中等查看答案及解析
-
反应 CO + H2O(g)
 CO2 + H2 在800℃达到平衡时,分别改变下列条件,K值发生变化的是( )
CO2 + H2 在800℃达到平衡时,分别改变下列条件,K值发生变化的是( )A.将压强减小至原来的一半 B.将反应温度升高至1000℃
C.添加催化剂 D.增大水蒸气的浓度
难度: 中等查看答案及解析
-
反应4A(s)+3B(g)
2C(g)+D(g),经2 min,B的浓度减少0.6 mol·L-1。对此反应速率的表示正确的是
A. 用A表示的反应速率是0.4 mol·(L·min) -1
B. 分别用B、C、D表示反应速率,其比值是3∶2∶1
C. 在2 min末的反应速率,用B表示是0.3 mol·(L·min) -1
D. 在2 min内的反应速率,用C表示是0.3 mol·(L·min) -1
难度: 中等查看答案及解析
-
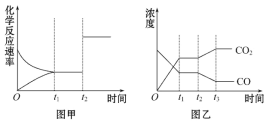
如图是可逆反应X2+3Y2
2Z在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是

A. t1时,只有正方向反应在进行
B. 0~t1,c(Z)在减小
C. t2~t3,反应不再进行
D. t2~t3,各物质的浓度不再发生变化
难度: 简单查看答案及解析
-
如图是相同条件下做H2O2分解的对比实验时,放出O2的体积随时间的变化关系示意图,a为使用催化剂,b为不使用催化剂,其中正确的图象是
A.
B.
C.
D.
难度: 中等查看答案及解析
-
已建立化学平衡的某可逆反应,当条件改变使化学平衡向正反应方向移动时,下列叙述正确的是
①生成物的质量分数一定增加 ②生成物的物质的量一定增加 ③反应物的转化率一定增大 ④平衡时反应物的浓度一定降低 ⑤正反应速率一定大于逆反应速率 ⑥一定使用了催化剂
A. ①②⑤ B. ④⑥ C. ②⑤ D. ③④⑤
难度: 中等查看答案及解析
-
下列叙述及解释正确的是
A. 2NO2(g)(红棕色)
N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅
B. H2(g)+I2(g)
2HI(g) ΔH<0,在平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变
C. FeCl3+3KSCN
Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl,因为平衡向逆反应方向移动,故体系颜色变浅
D. 对于N2+3H2
2NH3,平衡后,压强不变,充入O2,平衡左移
难度: 中等查看答案及解析
-
判断A(g)+B(g)
C(g)+D(g)是否达到平衡的依据为( )
A. 压强不随时间改变
B. 气体的密度不随时间改变
C. c(A)不随时间改变
D. 单位时间里生成C和D的物质的量相等
难度: 中等查看答案及解析
-
放热反应CO(g)+H2O(g)
CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则( )
A. K2和K1的单位均为mol·L-1
B. K2>K1
C. c2(CO)=c2(H2O)
D. c1(CO)>c2(CO)
难度: 中等查看答案及解析
-
在密闭容器中,N2(g)+3H2(g)
2NH3(g) ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,改变的这一条件是

A. 加入适当催化剂
B. 升高温度
C. 增大反应物的浓度
D. 增大压强
难度: 简单查看答案及解析
-
反应C(s)+H2O(g)
CO(g)+H2(g),在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大 ④保持压强不变,充入N2使容器体积变大
A. ①④ B. ②③ C. ①③ D. ②④
难度: 困难查看答案及解析
-
在一定温度下的可逆反应:mA(g)+nB(g)
pC(g)+qD(g),生成物C的体积分数与压强p1和p2、时间t1和t2的关系如图所示,则下列关系正确的是
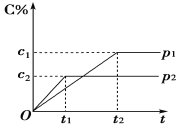
①p1>p2 ②p1<p2 ③m+n>p+q ④m+n=p+q ⑤m+n<p+q
A. ②③ B. ①③ C. ②⑤ D. ①④
难度: 中等查看答案及解析
-
(题文)1000 K时反应C(s)+2H2(g)
CH4(g)的K =8.28×107,当各气体物质的量浓度分别为0.7 mol·L-1 H2、0.2 mol·L-1 CH4时,对上述反应说法正确的是
A. 正向移动 B. 逆向移动 C. 达到平衡 D. 不一定
难度: 中等查看答案及解析
-
在两个恒容的密闭容器中进行下列两个可逆反应:
甲:C(s)+H2O(g)
CO(g)+H2(g)
乙:CO(g)+H2O(g)
CO2(g)+H2(g)
现有下列状态:①混合气体平均相对分子质量不再改变
②恒温时,气体压强不再改变 ③各气体组成浓度相等
④反应体系中温度保持不变 ⑤断裂氢氧键速率是断裂氢氢键速率的2倍 ⑥混合气体密度不变 ⑦单位时间内,消耗水蒸气质量与生成氢气质量比为9∶1
其中能表明甲、乙容器中反应都达到平衡状态的是( )
A. ①②⑤ B. ③④⑥ C. ⑥⑦ D. ④⑤
难度: 简单查看答案及解析
-
在密闭容器中发生如下反应: aX(g) + bY(g) ⇌cZ(g) +d W(g)。反应达平衡后保持温度不变,将气体体积压缩到原来的1/2,当再次达平衡时,W的浓度为原平衡时的1.8倍。下列叙述中不正确的是 ( )
A. 平衡向逆反应方向移动 B. a + b < c + d
C. Z的体积分数增加 D. X的转化率下降
难度: 简单查看答案及解析