-
下列溶液中溶质的物质的量浓度为1mol/L的是( )
A. 将58.5gNaCl溶解在1L水中
B. 将1L10mol/L的浓盐酸加入9L水中
C. 将22.4LHCl气体溶于水配成1L溶液
D. 将10gNaOH溶解在少量水中,再加蒸馏水直到溶液体积为250mL
难度: 中等查看答案及解析
-
下列叙述正确的是
A. 1molH2O的质量为18g/mol
B. CH4的摩尔质量为16g
C. 0.5NA个SO2分子的质量为32g
D. 标准状况下,1mol任何物质体积均为22.4L
难度: 中等查看答案及解析
-
化学是一门以实验为基础的学科,化学实验是化学学习的重要内容。根据你掌握的知识判断,下列实验操作的描述中,正确的是
A. 从试剂瓶中取出的任何药品,若有剩余不能再放回原试剂瓶
B. 用稀盐酸洗涤盛放过石灰水的试剂瓶
C. 酒精灯不慎碰倒起火时可用水扑灭
D. 各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘纸上称量
难度: 中等查看答案及解析
-
现有①MgSO4 ②Ba(NO3)2 ③NaOH ④CuCl2四种溶液,不加其他试剂即可鉴别出来,鉴别的先后顺序是( )
A. ③④②① B. ③④①②
C. ②①③④ D. ④③①②
难度: 中等查看答案及解析
-
用0.2mol·L-1某金属阳离子Rn+的盐溶液40mL,恰好将20 mL0.4mol·L-1的硫酸盐中的硫酸根离子完全沉淀,则n值为
A. 1 B. 2 C. 3 D. 4
难度: 困难查看答案及解析
-
《茶疏》中对泡茶过程有如下记载:“治壶、投茶、出浴、淋壶、烫杯、酾茶、品茶…… ”文中未涉及下列操作原理的是
A. 溶解 B. 萃取 C. 蒸馏 D. 过滤
难度: 简单查看答案及解析
-
利用下列实验装置完成相应的实验,能达到实验目的的是
A. 浓硫酸稀释
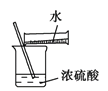 B. 除去酒精中溶有的少量水
B. 除去酒精中溶有的少量水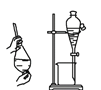 C. 实验室制取少量蒸馏水
C. 实验室制取少量蒸馏水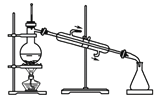 D. 制备并检验氢气的可燃性
D. 制备并检验氢气的可燃性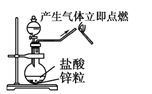
难度: 简单查看答案及解析
-
对于某些离子的检验及结论一定正确的是
A. 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32-
B. 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42-
C. 加稀硝酸酸化后,溶液中无明显变化,再加入AgNO3溶液,生成白色沉淀,能确定有Cl-存在
D. 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.在标准状况下,1mol水的体积是22.4L
B.1molH2所占的体积一定是22.4L
C.在标准状况下,NA个任何分子所占的体积约为22.4L
D.在标准状况下,质量为28g的CO气体,其体积约为22.4L
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数,下列说有关说法正确的是
A. 在常温常压下,11.2L N2含有的分子数小于0.5NA
B. 标准状况下,2.24L SO3含有的原子数为0.4NA
C. 将1L 2mol/L的FeCl3溶液,其中含有Cl-为2NA
D. 46g NO2和N2O4混合气体所含氧原子数目有可能为3NA
难度: 中等查看答案及解析
-
mg O2和 O3的混合气体中含有n个O原子,则阿伏伽德罗常数NA可表示为
A. 40n/m mol-1 B. 16n/m mol-1
C. n/40m mol-1 D. n/16m mol-1
难度: 困难查看答案及解析
-
20 g物质A和14 g物质B完全反应,生成8.8 g物质C、3.6 g物质D和0.2 mol物质E。则E的摩尔质量为( )
A. 100 g·mol-1 B. 108 g·mol-1
C. 111 g·mol-1 D. 123 g·mol-1
难度: 困难查看答案及解析
-
200 mL 0.3 mol/L的K2SO4溶液和100 mL 0.2 mol/L的Fe2(SO4)3溶液混合后(不考虑混合后溶液体积的变化),溶液中SO42-的物质的量浓度为
A. 0.3 mol/L B. 0.4 mol/L C. 0.45 mol/L D. 0.5 mol/L
难度: 中等查看答案及解析
-
标准状况下,aLHCl溶于1000g水中,得到的盐酸密度为bg·mL-1,则该盐酸浓度是:
A. a/22.4 mol·L-1
B. ab/22400 mol·L-1
C. ab/(22400+36.5) mol·L-1
D. 1000ab/(22400+36.5a) mol·L-1
难度: 中等查看答案及解析