-
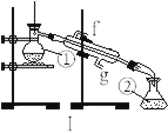
过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4 等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2 溶液;④滴入稀盐酸至无气泡产生;⑤过滤正确的操作顺序是( )
A. ③②①⑤④ B. ①②③⑤④ C. ②③①④⑤ D. ③⑤②①④
难度: 中等查看答案及解析
-
检验某未知溶液中是否含有SO42-,下列操作最合理的是 ( )
A. 加入稀硝酸酸化的Ba(NO3)2溶液
B. 加入盐酸酸化的BaCl2溶液
C. 先加稀硝酸酸化,再加Ba(NO3)2溶液
D. 先加盐酸酸化,再加BaCl2溶液
难度: 中等查看答案及解析
-
如果你在厨房不小心将花生油与凉开水混在一起,你将采用下列何种方法进行分离
A. 过滤 B. 蒸馏 C. 分液 D. 萃取
难度: 简单查看答案及解析
-
有一份气体样品的质量是14.2 g,体积是4.48 L(标准状况下),该气体的摩尔质量( )。
A. 28.4 B. 28.4 g/mol C. 71 D. 71 g/mol
难度: 简单查看答案及解析
-
对危险化学品要在包装标签上印有警示性标志。氢氧化钠溶液应选用的标志是
A.
 B.
B.  C.
C.  D.
D. 
难度: 简单查看答案及解析
-
广州的自来水是采用氯气消毒的,为了检验Cl-的存在,最好选用下列物质中的
A. 石蕊溶液 B. 四氯化碳
C. 氢氧化钠溶液 D. 稀硝酸和硝酸银溶液
难度: 简单查看答案及解析
-
A. 不慎将浓硫酸沾到皮肤上,立即用大量水冲洗。
B. 在食盐溶液蒸发结晶的过程中,当蒸发皿中出现较多量固体时即停止加热。
C. 先在天平两个托盘上各放一张相同质量的纸,再把氢氧化钠固体放在纸上称量。
D. 过滤时,慢慢地将液体直接倒入过滤器中。
难度: 简单查看答案及解析
-
下列实验中均需要的仪器是( )
①配制一定物质的量浓度的溶液 ②PH试纸的使用 ③过滤 ④蒸发
A. 试管 B. 胶头滴管
C. 玻璃棒 D. 漏斗
难度: 中等查看答案及解析
-
标准状况的温度和压强是
A. 20℃,101kPa B. 0℃,101Pa
C. 25℃,101kPa D. 0℃,101kPa
难度: 简单查看答案及解析
-
某气体对氧气的相对密度为2,则该气体可能为
A. H2 B. O2 C. CO2 D. SO2
难度: 中等查看答案及解析
-
已知3.01×1023个X气体分子的质量为16 g,则X气体的摩尔质量是
A. 16 g B. 32 g C. 64 g /mol D. 32 g /mol
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 1 mol氯含有6.02×1023个微粒
B. 阿伏加德罗常数的数值约等于6.02×1023
C. 钠的摩尔质量等于它的相对原子质量
D. H2O的摩尔质量是18 g
难度: 简单查看答案及解析
-
下列说法正确的是
A. 摩尔是一种国际基本物理量
B. 在同温同压下,相同体积的任何气体所含分子数都相同
C. 1mol氧气的质量为32g.mol﹣1
D. 标准状况下气体的摩尔体积为22.4L
难度: 简单查看答案及解析
-
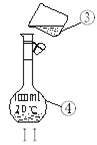
容量瓶上标有:①温度、②浓度、③容量、④压强、⑤刻度线、⑥酸式或碱式这六项中的
A. ①③⑤ B. ③⑤⑥ C. ①②④ D. ②④⑥
难度: 简单查看答案及解析
-
根据阿伏加德罗理论:在相同温度和压强下,相同体积的任何气体都含有相同数目的粒子.在一定温度和压强下,1体积的A2气体和3体积的B2气体合成2体积的C气体,则C气体的化学式为( )
A.AB B.AB3 C.A3B D.A2B3
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 常温常压下,16 g O3气体含有氧原子数为NA
B. 标准况状下,44.8 LH2O含有的分子数为2NA
C. 0.5 mol H2的质量为1 g,体积为11.2 L
D. 2.4 g金属镁变为镁离子时失去的电子数为0.1NA
难度: 中等查看答案及解析
-
某盐的溶液中含有Na+、Mg2+、Cl﹣、SO42﹣四种离子,Na+为0.2mol,Mg2+为0.4mol,Cl﹣为0.4mol,则SO42﹣物质的量为
A. 0.1mol B. 0.3mol C. 0.5mol D. 0.15mol
难度: 中等查看答案及解析
-
下列说法正确的是
A. 1molCH3+(碳正离子)含有9 NA个电子
B. 2.5molHe 中含有10 NA个质子
C. 6.02×1022 个H2SO4分子在溶液中可电离出2NA个H+
D. 1molFe与盐酸完全反应可失去电子的物质的量为2NA
难度: 中等查看答案及解析