-
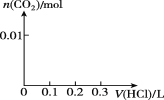
物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当溶液的体积比为3∶2∶1时,三种溶液中Cl-的物质的量之比为
A. 1∶1∶1 B. 1∶2∶3
C. 3∶2∶1 D. 3∶4∶3
难度: 中等查看答案及解析
-
下列各组混合物中,能用分液漏斗进行分离的是( )
A. 酒精和水 B. 碘和四氯化碳 C. 水和四氯化碳 D. 汽油和植物油
难度: 简单查看答案及解析
-
等体积的两容器内,一个盛CH4,另一个盛NH3,若容器内温度、压强相同,则两容器内所盛气体比较,结论一定不正确的是( )
A. 分子个数比为1∶1 B. 原子个数比为5∶4
C. 质量比为17∶16 D. 氢原子个数比为4∶3
难度: 简单查看答案及解析
-
下列各项操作中,错误的是( )
A. 用酒精萃取溴水中的溴单质的操作可选用分液漏斗,而后静置分液
B. 进行萃取操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
C. 萃取分液前需对分液漏斗检漏
D. 为保证分液漏斗内的液体顺利流出,需将上面的塞子拿下
难度: 中等查看答案及解析
-
下列说法中不正确的是( )
A. Ba2++SO42—=BaSO4↓可表示氯化钡溶液与硫酸钠溶液的反应
B. H++OH-=H2O可表示强碱氢氧化钠、氢氧化钾分别与盐酸、硫酸间的反应
C. CO32—+2H+=CO2↑+H2O表示可溶性碳酸盐与强酸之间的复分解反应
D. BaCO3+2H+=Ba2++CO2↑+H2O表示碳酸钡与强酸之间的复分解反应
难度: 中等查看答案及解析
-
在澄清透明强酸性溶液中,能大量共存的离子组是( )
A. K+、Cu2+、OH﹣、SO42— B. Fe3+、NH4+、NO3—、Cl﹣
C. K+、Na+、Cl﹣、CO32— D. K+、Fe2+、MnO4—、SO42—
难度: 中等查看答案及解析
-
若NA表示阿伏加德罗常数,下列说法中,正确的是( )
A. 1 mol Cl2作为氧化剂得到的电子数为NA
B. 在0 ℃,101 kPa时,22.4 L氢气中含有NA个氢原子
C. 25 ℃,1.01×105Pa,64 g SO2中含有的原子数为3NA
D. 将0.1 mol FeCl3加到沸水中制得的胶体中,含胶粒0.1NA
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A. 1 mol H2SO4 的质量为98 g·mol-1 B. 常温常压下11.2LCO2所含分子数为0.5NA
C. H2SO4 的摩尔质量为98 g D. 6.02×1022个H2SO4分子的质量为9.8 g
难度: 简单查看答案及解析
-
在反应C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O中,氧化产物是
A. C B. H2SO4 C. CO2 D. SO2
难度: 简单查看答案及解析
-
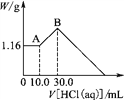
已知:还原性强弱:I- >Fe2+。往100 mL碘化亚铁溶液中缓慢通入3.36 L(标准状况)氯气,反应完成后溶液中有1/2的Fe2+被氧化成Fe3+。则原碘化亚铁溶液的物质的量浓度为
A. 1.1mol·L-1 B. 1.5mol·L-1 C. 1.2mol·L-1 D. 1.0mol·L-1
难度: 中等查看答案及解析
-
一定物质的量的SO2 与NaOH溶液反应,所得溶液中含Na2SO3与 NaHSO3 物质的量之比为3:5,则参加反应的SO2与NaOH 物质的量之比为( )
A. 3:5 B. 1:2 C. 18:8 D. 8:11
难度: 中等查看答案及解析
-
V L硫酸铝溶液中含Al3+的质量为m g,则溶液中SO42-的物质的量浓度为:
A.
mol·L-1 B.
mol·L-1 C.
mol·L-1 D.
mol·L-1
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是( )
A. 碳酸钠溶液中滴入过量的醋酸溶液:CO32-+2H+=H2O+CO2
B. Fe3+的检验:Fe3++3SCN-
Fe(SCN)3↓
C. 酸性溶液中KIO3与KI反应生成I2:IO3﹣+5I﹣+6H+=3I2+3H2O
D. 碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++HCO3-+OH-=CaCO3+H2O
难度: 困难查看答案及解析
-
酸性溶液中离子还原性强弱为:SO2>I->Fe2+>H2O2>Cl-,则下列反应不可能发生的是( )
A. 2Fe3++2H2O+SO2=2Fe2++SO42-+4H+ B. 2Fe2++Cl2=2Fe3++2Cl-
C. I2+SO2+2H2O=H2SO4+2HI D. H2O2+H2SO4=SO2↑+O2↑+2H2O
难度: 中等查看答案及解析