-
人们的生活、生产与化学息息相关,下列说法正确的是
A. 复旦大学研究的能导电、存储的二维材料二硫化钼是一种新型有机功能材料
B. 中国天眼用到碳化硅、芯片用到高纯硅、石英玻璃用到硅酸盐
C. 中国歼-20上用到的氮化镓材料是当做金属合金材料使用的
D. 石墨烯弹性气凝胶制成的碳海绵可用作处理原油泄漏的吸油材料
难度: 中等查看答案及解析
-
下列化学用语正确的是
A. 雕刻玻璃的试剂主要成分的电子式为:
B. 新制氯水中含氧酸的结构式:H—Cl—O
C. S2-的结构示意图
D. 标准状况下密度为1.25g/L的气态烃的球棍模型:
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A. S2和S8的混合物共6.4g,其中所含的电子数一定为3.2NA
B. 密闭容器中2mol NO与1mol O2充分反应,产物的分子数为2NA
C. 24g二氧化硅晶体中含有SiO2分子数为0.4 NA
D. 5.6gFe与含0.2molHNO3的溶液充分反应,至少失去电子数为0.2 NA
难度: 中等查看答案及解析
-
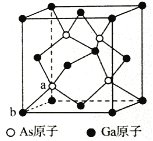
被誉为“矿石熊猫”的香花石,由我国地质学家首次发现,它由前20号元素中的6种组成,分别为X、Y、Z、W、R、T。其中Ⅹ、Y、Z为金属元素,Z的最外层电子数与次外层电子数相等,X、Z位于同族,Y、Z、R、T位于同周期,R最外层电子数是次外层的3倍,T无正价,X与R原子序数之和是W的2倍。下列说法错误的是
A. 原子半径:Y>Z>R>T
B. 气态氢化物的稳定性:W<R<T
C. 最高价氧化物对应的水化物的碱性:X>Z
D. XR2、WR2两种化合物中R的化合价相同
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式是
A. 用石墨作电极电解CuCl2溶液:2Cl-+2H2O
2OH-+Cl2↑+H2↑
B. 0.01mol/LNH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O
C. 将少量二氧化硫通入次氯酸钠溶液:SO2+ClO-+2OH-=SO42-+Cl-+H2O
D. Ca(HCO3)2溶液与过量NaOH溶液反应:Ca2++HCO3-+OH-=CaCO3+H2O
难度: 中等查看答案及解析
-
有机物a和苯通过反应合成b的过程如图(无机小分子产物略去)。下列说法正确的是
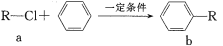
A. 该反应是加成反应
B. 若R为CH3时,b中所有原子可能共面
C. 若R为C4H9时,取代b苯环上的氢的一氯代物的可能的结构共有4种
D. 若R为C4H5O时,1molb最多可以与5molH2加成
难度: 中等查看答案及解析
-
下列叙述或书写正确的是
A. 2H2(g)+O2(g)=2H2O(g)ΔH=-483.6kJ·mol-1,则1mol氢气的燃烧热大于241.8 kJ·mol-1
B. H2(g)+F2(g)=2HF(g)ΔH=-270kJ·mol-1,则相同条件下,2molHF气体的能量大于1mol氢气和1mol 氟气的能量之和
C. 含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该中和反应的热化学方程式为NaOH+HCl=NaCl+H2OΔH=-57.4kJ·mol-1
D. 500℃、30MPa时,发生反应N2(g)+3H2(g)
2NH3(g) ΔH=-38.6kJ·mol-1。在此条件下将1.5molH2和过量N2充分反应,放出热量19.3kJ
难度: 中等查看答案及解析
-
利用右图所示装置进行下列实验,能得出相应实验结论的是( )
选项
①
②
③
实验结论
实验装置
A
稀硫酸
Na2S
AgNO3与AgCl的溶液
Ksp(AgCl)>Ksp(Ag2S)
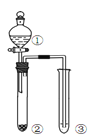
B
浓硫酸
蔗糖
溴水
浓硫酸具有脱水性、氧化性
C
稀盐酸
Na2SO3
Ba(NO3)2 溶液
SO2与可溶性钡盐均可以生成白色沉淀
D
浓硝酸
Na2CO3
Na2SiO3溶液
酸性:硝酸>碳酸>硅酸
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
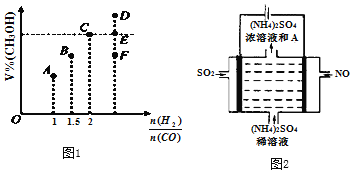
CH3OH是重要的化工原料,工业上用CO与H2在催化剂作用下合成CH3OH,其反应为:CO(g)+2H2(g)⇌CH3OH(g)。按n(CO):n(H2)=1:2,向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法中,正确的是
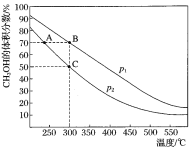
A. p1<p2
B. 该反应的ΔH>0
C. 平衡常数:K(A)=K(B)
D. 在C点时,CO转化率为75%
难度: 困难查看答案及解析
-
下表是25°C时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是
化学式
AgCl
Ag2CrO4
CH3COOH
HClO
H2CO3
KSP或Ka
KSP=1.8×10-10
KSP=2.0×10-12
Ka=1.8×10-5
Ka=3.0×10-8
Ka1=4.1×10-7
Ka2=5.6×10-11A.相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是
c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B.碳酸钠溶液中滴加少量氯水的离子方程式为CO32-+Cl2=HCO3-+Cl-+HClO
C.向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=5
D.向浓度均为1×10-3mol·L-1的KCl和K2CrO4混合液中滴加1×10-3mol·L-1的AgNO3溶液,CrO42-先形成沉淀
难度: 困难查看答案及解析
-
新华网报道,我国固体氧化物燃料电池技术研发取得新突破。科学家利用该技术实现了H2S废气资源回收能量,并得到单质硫的原理如图所示。
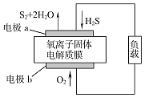
下列说法正确的是
A. 电极b为电池负极
B. 电路中每流过4mol电子,正极消耗44.8LH2S
C. 电极b上的电极反应为:O2+4e-+4H+=2H2O
D. 电极a上的电极反应为:2H2S+2O2--4e-=S2+2H2O
难度: 困难查看答案及解析
-
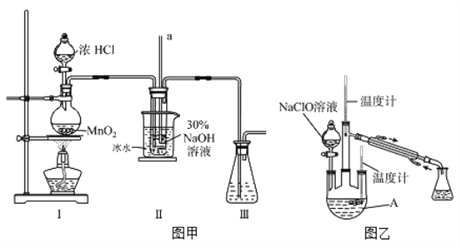
下列实验现象预测、实验设计、仪器使用能达到目的是
A. 模拟工业制氨气并检验产物
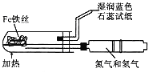
B. 实验室采用所示装置收集SO2
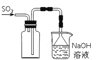
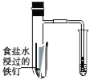
C. 可用所示装置验证铁发生析氢腐蚀
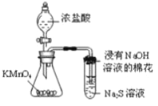
D. 可用所示装置比较KMnO4、Cl2、S的氧化性强弱
难度: 中等查看答案及解析
-
常温下,0.1mol Na2CO3与盐酸混合所得的一组体积为1L的溶液,溶液中部分微粒与pH的关系如图所示。下列有关溶液中离子浓度关系叙述正确的是
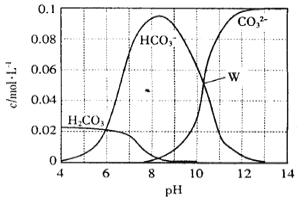
A. W点所示的溶液中:c(Na+)>c(CO32-)= c(HCO3-)>c(OH-)>c(H+)
B. pH=4的溶液中:c(H2CO3)+c(HCO3-)+ c(CO32-)=0.1mol/L
C. pH=8的溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
D. pH=11的溶液中:c(Na+)+c(H+)=c(OH-)+c(Cl-)+c(CO32-)+c(HCO3-)
难度: 困难查看答案及解析
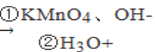 CH3COOH+CH3CH2COOH
CH3COOH+CH3CH2COOH