-
相同温度下,根据三种酸的电离常数,下列判断正确的是( )
酸
HX
HY
HZ
电离常数K
9×10-7
9×10-6
1×10-2
A. 三种酸的强弱关系:HX>HY>HZ
B. 反应HZ+Y-===HY+Z-能够发生
C. 相同温度下,0.1 mol·L-1的NaX、NaY、NaZ溶液,NaZ溶液pH最大
D. 相同温度下,1 mol·L-1 HX溶液的电离常数大于0.1 mol·L-1 HX
难度: 简单查看答案及解析
-
下列变化中,前者是物理变化,后者是化学变化,且都有明显颜色变化的是( )
A. 打开盛装NO的集气瓶;冷却NO2气体
B. 用冰水混合物冷却SO3气体;加热氯化铵晶体
C. 木炭吸附NO2气体;将氯气通入品红溶液中
D. 向酚酞溶液中加入Na2O2;向FeCl3溶液中滴加KSCN溶液
难度: 中等查看答案及解析
-
1.52g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL (标准状况),向反应后的溶液中加入1.0mol/LNaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀,下列说法不正确的是
A. 该合金中铜与镁的物质的量之比是2 ︰1
B. 该浓硝酸中HNO3的物质的量浓度是14.0mol/L
C. NO2和N2O4的混合气体中,NO2的体积分数是80%
D. 得到2.54沉淀时,加入NaOH溶液的体积是600mL
难度: 简单查看答案及解析
-
化学与生产、生活密切相关。下列说法不正确的是
A. 食盐可作调味剂,也可用作食品防腐剂
B. 二氧化硫可用于制作葡萄酒的食品添加剂
C. 还原铁粉和生石灰均可用作食品包装袋内的脱氧剂
D. “地沟油”禁止食用,但可用来制取肥皂
难度: 简单查看答案及解析
-
下列有关说法中,不正确的是
A. 焰火的五彩缤纷是某些金属元素的性质的展现
B. SiO2可用于制造光导纤维,其性质稳定,不溶于强酸、强碱
C. “光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化物有关
D. 根据分散质微粒直径大小可以将分散系分为溶液、胶体和浊液
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 6.8 g熔融的KHSO4中含有0.05 NA个阴离子
B. 1.0 L 2 mol/L的NaOH水溶液中含有的氧原子数目为2NA
C. 25℃时,p H=13的氢氧化钡溶液中含有0.1 NA个OH—
D. 5.6g铁与一定量稀硝酸完全反应,电子转移数目一定为0.3 NA
难度: 中等查看答案及解析
-
下列叙述正确的是
A. 酸性氧化物和碱性氧化物都是电解质
B. 将NaOH溶液逐滴加入FeCl3溶液可制备Fe(OH)3胶体
C. 电化学腐蚀是造成金属腐蚀的主要原因
D. 离子键一定只存在于离子化合物中,共价键一定只存在于共价化合物中
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A. 向Na2S2O3溶液中加入稀盐酸:2S2O32-+2H+ = SO42-+3S↓+H2O
B. 磁性氧化铁溶于稀硝酸:3 Fe3O4+28H++NO3- == 9 Fe3++NO↑+14 H2O
C. 100 mL 0.1 mol/L Fe I2溶液与标准状况下0.224 L Cl2: 2 Fe2++C12 = Fe3++2 Cl一
D. 向明矾溶液中滴加Ba(OH)2溶液,恰好SO42-沉淀完全:2 A13++3SO42-+3Ba2+ + 6OH— === 2 A1(OH)3↓+3 BaSO4↓
难度: 中等查看答案及解析
-
常温下,在下列给定条件的各溶液中,一定能大量共存的离子组是
A. pH大于7的溶液:Na+、Ba2+、SO32-、ClO—
B. 含有0.1 mol·L—1 Fe(NO3)2的溶液:H+、Mg2+、SCN一、Cl一
C. 使酚酞溶液变红色的溶液:Na+、Ba2+、I、Cl—
D. 由水电离产生的c(H+)=10—13 mol·L—l的溶液:NH4+、SO42-、NO3- 、Cl一
难度: 中等查看答案及解析
-
用下面的方案进行某些离子的检验,其中方案设计严密的是( )
A. 检验试液中的SO42-:试液
无沉淀
白色沉淀
B. 检验试液中的SO32-:试液
气体
褐色
C. 检验试液中的I—:无色试液
棕黄色溶液
蓝色溶液
D. 检验试液中的CO32-:试液
白色沉淀
沉淀溶解
难度: 中等查看答案及解析
-
下列实验方案的设计能达到目的的是
选项
实验目的
实验方案
A
证明Ksp(AgCl)>Ksp(AgI)
向盛有2 mL0.1 mol/LAgNO3溶液的试管中,先滴几滴0.1 mol/LKCl溶液,再滴加0.1mol/LKI溶液。试管先出现白色沉淀,后出现淡黄色沉淀
B
制备Fe(OH)3胶体
在NaOH溶液中加入饱和的FeCl3溶液,加热煮沸
C
检验淀粉水解液是否具有还原性
取淀粉水解液于试管中,滴入新制的Cu(OH)2加热煮沸,观察现象
D
探究化学反应的限度
取5mL 0.1mol/L KI溶液和1mL 0.1mol/L FeCl3溶液混合,充分反应后,再根据溶液中是否含有Fe2+、Fe3+来判断该反应是否有一定限度
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
称取(NH4)2SO4和NH4HSO4混合物样品7.24 g,加入含0.1 mol NaOH的溶液,完全反应,生成NH31792 mL(标准状况),则(NH4)2SO4和NH4HSO4的物质的量比为
A. 1:1 B. 1:2 C. 1.87:1 D. 3.65:1
难度: 中等查看答案及解析
-
下列有关实验装置进行的相应实验,不能达到实验目的的是( )
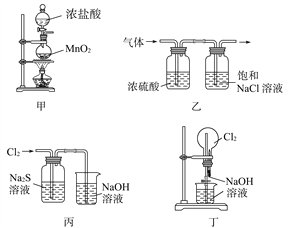
A. 用装置甲制取氯气
B. 用装置乙除去氯气中的少量氯化氢和水蒸气
C. 用装置丙可证明Cl2的氧化性强于S
D. 用装置丁可以完成“喷泉”实验
难度: 中等查看答案及解析
-
已知溶液中:氧化性IO3—>I2>SO32-。向含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如右图所示,下列说法正确的是

A. a点反应的还原剂是NaHSO3,被氧化的元素是碘元素
B. b点反应的离子方程式是:3HSO3-+IO3-+3OH-=3SO42-+I-+3H2O
C. c点到d点的反应中共转移0.6mol电子
D. 往200mL 1 mol/L的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式是:5 HSO3- + 2IO3- == I2+ 5SO42-+ 3H++ H2O
难度: 困难查看答案及解析
-
某溶液中可能大量存在:H+、Na+、Fe2+、Al3+、NH4+、SO42-、Cl-中的几种离子,现进行了如下实验:
① 取该溶液10.0mL,加入过量Ba(NO3)2溶液,产生白色沉淀x和无色气体a,a遇空气立即变为红棕色气体b;过滤。
② 向①所得的滤液中加入过量NaOH溶液,产生红褐色沉淀y,过滤,加热滤液有无色刺激性气体c生成;用铂丝蘸取滤液,在火焰上灼烧,火焰呈黄色。
③ 向②所得的滤液中通入过量CO2气体有白色沉淀z生成。
下列推断错误的是
A. 原溶液一定只含有:Na+、Fe2+、Al3+、SO42-
B. 实验① 的红棕色气体b中存在:2NO2
N2O4。
C. 实验② 中产生沉淀y的反应:Fe3++3OH-=Fe(OH)3↓
D. 实验③ 中CO2先后分别与NaOH(aq)、NaAlO2(aq)反应
难度: 中等查看答案及解析
-
在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合溶液中Al2(SO4)3与MgSO4的物质的量浓度之比为( )
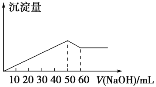
A. 6∶1 B. 3∶1 C. 2∶1 D. 1∶2
难度: 困难查看答案及解析
-
以硫铁矿(主要成分为
)为原料制备氯化铁晶体(
)的工艺流程如下所示:
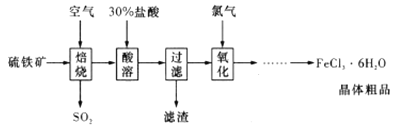
下列说法不正确的是
A. “酸溶”过程中使用的酸也可以是硝酸
B. 为防止污染,“焙烧”过程中产生的
应回收利用
C. 通入氯气的目的是氧化
D. 用
制取无水
时,需要在氯化氢气流中加热
难度: 中等查看答案及解析


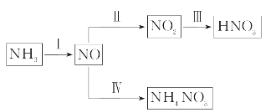
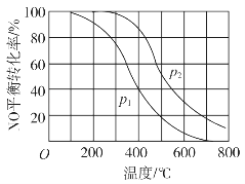
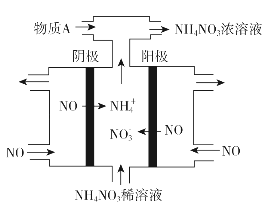 .
.