-
在两个容积相同的容器中,一个盛有HCl气体,另一个盛满H2和Cl2的混合气体在同温同压下,两个容器内的气体一定具有相同的( )
A. 原子数 B. 密度 C. 质量 D. 质子数
难度: 中等查看答案及解析
-
将下列各组物质按酸、碱、盐的分类依次排列,正确的是( )
A. 硫酸、纯碱、石膏 B. 硫酸、烧碱、胆矾
C. 硫酸氢钠、生石灰、醋酸钠 D. 磷酸、熟石灰、苛性钠
难度: 简单查看答案及解析
-
下列事故或药品的处理正确的是( )
A. 少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗
B. 当出现CO中毒时,应立即将中毒者抬到室外新鲜空气处
C. 制取并收集氧气结束后,应立即停止加热
D. 将含硫酸的废液倒入水槽,用水冲入下水道
难度: 中等查看答案及解析
-
胶体区别于其他分散系的最本质特征是( )
A. 能产生丁达尔效应 B. 粒子带电
C. 能透过滤纸 D. 分散质粒子的直径在1~100nm之间
难度: 简单查看答案及解析
-
下列实验装置或操作正确的是( )
A. 向容量瓶中转移液体
 B. 实验室制取蒸馏水
B. 实验室制取蒸馏水 C. 从饱和食盐水中提取氯化钠晶体
C. 从饱和食盐水中提取氯化钠晶体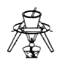 D. 分离酒精和水
D. 分离酒精和水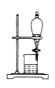
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 不能发生丁达尔效应的分散系有氯化钠溶液、水等
B. 将1L 2mol·L-1的FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数为2NA
C. 黄河入海口处三角洲的形成与胶体性质有关
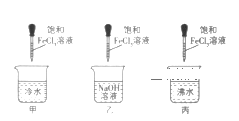
D. 将饱和FeCl3溶液加热至沸腾,制得Fe(OH)3胶体
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数,下列说法正确的是( )
A. 2.4g金属镁变成镁离子时失去的电子数目为0.1NA
B. 常温下,2g氢气所含分子数目为NA
C. 在25℃,1.01×105Pa时,11.2L氮气所含的原子数目为NA
D. 标准状况下体积约为22.4LH2和O2的混合气体所含分子数为2NA
难度: 中等查看答案及解析
-
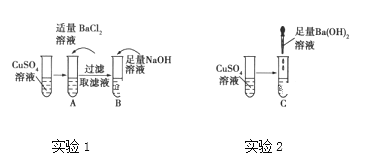
下列指定反应的离子方程式正确的是( )
A. Fe与稀硫酸反应:2Fe+6H+=Fe3++3H2↑
B. Cu与AgNO3溶液反应:Cu+2Ag+=Cu2++2Ag
C. 向氢氧化钡溶液中加入稀硫酸:Ba2++OH-+H++SO42-=BaSO4↓+H2O
D. 向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO3-+OH-=CaCO3↓+H2O
难度: 中等查看答案及解析