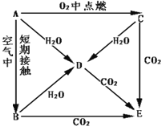
-
下列反应与Na2O2+SO2→Na2SO4相比较,Na2O2的作用相同的是
A. 2Na2O2+2CO2→2Na2CO3+O2 B. 2Na2O2+2SO3→2Na2SO4+O2
C. 2Na2O2+H2SO4→Na2SO4+H2O2 D. 3Na2O2+Cr2O3→2Na2CrO4+Na2O
难度: 简单查看答案及解析
-
被称为万能还原剂的NaBH4(NaBH4中H为-1价)能溶于水并和水反应,有如下反应
NaBH4+2H2O=NaBO2+4H2↑,下列有关该反应的说法中,正确的是
A. NaBH4既是氧化剂又是还原剂
B. NaBH4是氧化剂,H2O是还原剂
C. 被氧化的元素与被还原的元素质量比为1∶1
D. 硼元素被氧化,氢元素被还原
难度: 中等查看答案及解析
-
下列选项中所涉及的两个量一定相等的是( )
A. 11.2 L Cl2与4.25 g NH3所含有的原子数
B. 等物质的量的Al分别与足量的盐酸、NaOH溶液反应转移的电子数
C. 标准状况下36 g H2O与1.204×1024个O2分子所占的体积
D. 18.0 g重水(D2O)与20 g Ne所含有的电子数
难度: 中等查看答案及解析
-
有一定质量的 Na2O2、Na2O、Na2CO3、NaOH的固体混合物,与400g质量分数为3.65%的盐酸恰好反应,蒸干溶液,最终得固体质量为( )
A. 16g B. 23.4g C. 31g D. 无法计算
难度: 中等查看答案及解析
-
下列离子方程式的书写正确是
A. 实验室用大理石和稀盐酸制取CO2:2H+ + CO32- = CO2↑+ H2O
B. 向NaOH溶液中加入铝粉来制备H2:Al+2OH-+2H2O=AlO2-+3H2↑
C. 氢氧化钡溶液与稀H2SO4 反应:Ba2++SO42-=BaSO4↓
D. 铁和稀盐酸反应:Fe + 2H+ =H 2↑+ Fe 2+
难度: 简单查看答案及解析
-
下列说法中,正确的是( )
A. 物质得电子的反应是氧化反应
B. 氧化剂是在反应中所含元素化合价降低的反应物
C. 氧化剂是在反应中失电子(或电子对偏离)的反应物
D. 在一个氧化还原反应中,氧化剂和还原剂不可能是同一种物质
难度: 中等查看答案及解析
-
已知X2、Y2、Z2、W2四种物质的氧化能力为W2>Z2>X2>Y2,下列氧化还原反应能发生的是
A. 2NaW+Z2===2NaZ+W2 B. 2NaX+Z2===2NaZ+X2
C. 2NaW+Y2===2NaY+W2 D. 2NaZ+X2===2NaX+Z2
难度: 简单查看答案及解析
-
关于钠的说法正确的是( )
A. 熔点很高 B. 在空气中燃烧时产生黄色火焰
C. 银白色金属,硬度大 D. 在空气中燃烧生成氧化钠
难度: 简单查看答案及解析
-
下列实验装置图所示的实验操作,不能达到相应的实验目的的是
A. 除去CO气体中的CO2
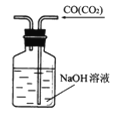 B. 分离沸点相差较大的互溶液体混合物
B. 分离沸点相差较大的互溶液体混合物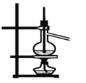 C. 容量瓶中转移液体
C. 容量瓶中转移液体 D. 分离互不相容的两种液体
D. 分离互不相容的两种液体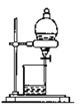
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数,下列叙述不正确的是
A. 通常状况下,1 mol SO3含有的分子数为NA
B. 1 mol OH-参与电解,转移的电子数目为NA
C. 标准状况下,含NA个氩原子的氩气体积约为22.4 L
D. 标准状况下,V L水含有的氧原子数约为VNA/22.4
难度: 简单查看答案及解析
-
下列关于实验的叙述正确的是
A. 向一定量的稀硫酸中加入除去油污的稍过量的废铁屑,是制备硫酸亚铁溶液的可行方案
B. 向煮沸的1mol/LNaOH溶液中滴加氯化铁饱和溶液制备氢氧化铁胶体
C. 向铝屑与硫酸反应后的溶液中加入氢氧化钠溶液反应,是制备氢氧化铝的最佳方案
D. 向某溶液中,依次加入氯水和硫氰化钾溶液,溶液变红,说明溶液中含有Fe2+
难度: 简单查看答案及解析
-
常温下,在由水电离产生的H+浓度为1×10-13 mol·L-1的溶液中,一定能大量共存的离子组是
①K+、Cl-、NO3-、S2- ②K+、Fe2+、I-、SO42-
③Na+、Cl-、NO3-、SO42- ④Na+、Ca2+、Cl-、HCO3- ⑤K+、Ba2+、Cl-、NO3-
A. ①③ B. ③⑤ C. ④⑤ D. ②⑤
难度: 中等查看答案及解析
-
已知:SO32—+I2+H2O===SO42—+2H++2I-,某溶液中可能含有I-、NH4+、Cu2+、SO32—,向该无色溶液中加入少量溴水,溶液仍呈无色,下列判断正确的是( )
A. 肯定不含I- B. 肯定不含NH4+ C. 可能含有SO32— D. 可能含有I-
难度: 困难查看答案及解析
-
向某NaOH溶液中通人CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同若向M中逐滴加人盐酸,产生的气体体积V(CO2)与加人盐酸的体积V(HCl)的关系有下列图示四种情况,且(2)(3)(4)图中分别有OA<AB,OA=AB,OA>AB,则下列分析与判断一定正确的是(不计CO2的溶解)
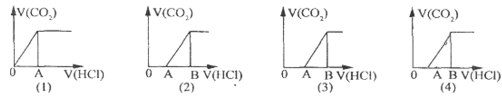
A. (1)图显示M中只有一种溶质且为Na2CO3
B. (3)图显示M中有两种溶质且为Na2CO3、NaOH
C. (2)图显示M中有两种溶质且为Na2CO3、NaHCO3
D. (4)图显示M中c(NaHCO3)=c(Na2CO3)
难度: 困难查看答案及解析
-
用含有少量Mg的Al片制取纯净的Al(OH)3,下列操作中最恰当的组合是( )
①加盐酸溶解 ②加NaOH溶液 ③过滤 ④通入过量CO2生成Al(OH)3 ⑤加盐酸生成Al(OH)3 ⑥加过量氨水生成Al(OH)3
A. ①⑥③ B. ①③⑥③ C. ②③④③ D. ②③⑤③
难度: 中等查看答案及解析
-
向100mL0.1mol⋅L−1硫酸铝铵溶液中逐滴滴入0.1mol⋅L−1Ba(OH)2溶液..随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示..则下列说法中正确的是
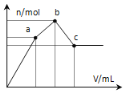
A. a点的溶液呈中性
B. 从开始到b点发生反应的总的离子方程式是:Al3++2SO42−+2Ba2++3OH−=Al(OH)3↓+2BaSO4↓
C. c点加入Ba(OH)2溶液的体积为200mL
D. c点溶液呈碱性
难度: 中等查看答案及解析
-
ClO2是一种杀菌消毒效率高、二次污染小的水处理剂。实验室中可通过以下反应制得:2KClO3+H2C2O4+H2SO4
2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是( )
A. CO2是氧化产物 B. H2C2O4在反应中被氧化
C. H2C2O4的氧化性强于ClO2的氧化性 D. ClO2作水处理剂时,利用了其强氧化性
难度: 困难查看答案及解析
-
已知M2On2-可与R2- 作用,R2-被氧化为R单质,M2On2-的还原产物中,M为+3价;又知 c(M2On2-)=0.3 mol·L-1的溶液100 mL可与c(R2-)=0.6 mol·L-1的溶液150 mL恰好完全反应,则n值为
A. 4 B. 5 C. 6 D. 7
难度: 中等查看答案及解析