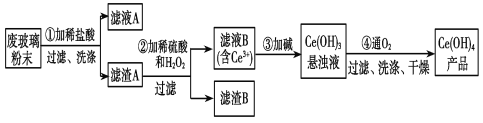
-
O2F2可以发生反应:H2S+4O2F2→SF6+2HF+4O2,下列说法正确的是( )
A. 氧气是氧化产物
B. O2F2既是氧化剂又是还原剂
C. 若生成4.48 L HF,则转移0.8 mol电子
D. 还原剂与氧化剂的物质的量之比为1:4
难度: 中等查看答案及解析
-
下列除杂方案错误的是
选项
被提纯的物质
杂质
除杂试剂
除杂方法
A
CO(g)
CO2(g)
NaOH 溶液、浓 H2SO4
洗气
B
NH4Cl(aq)
Fe3+(aq)
NaOH溶液
过滤
C
Cl2(g)
HCl(g)
饱和食盐水、浓H2SO4
洗气
D
Na2CO3(s)
NaHCO3(s)
—
灼烧
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增大,X原子的最外层有6个电子,Y是迄今发现的非金属性最强的元素,在周期表中Z位于ⅠA族,W与X属于同一主族。下列说法正确的是
A. 元素X、W的简单阴离子具有相同的电子层结构
B. 由Y、Z两种元素组成的化合物是离子化合物
C. W的简单气态氢化物的热稳定性比Y的强
D. 原子半径:r(X)<r(Y)<r(Z)<r(W)
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值。下列说法正确的是
A. 18 g D2O和18 g H2O中含有的质子数均为10NA
B. 2 L 0.5 mol·L-1亚硫酸溶液中含有的H+离子数为2NA
C. 过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA
D. 密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA
难度: 中等查看答案及解析
-
下列说法正确的是
A. I的原子半径大于Br,HI比HBr的热稳定性强
B. P的非金属性强于Si,H3PO4比H2SiO3的酸性强
C. Al2O3和MgO均可与NaOH溶液反应
D. SO2和SO3混合气体通入Ba(NO3)2溶液可得到BaSO3和BaSO4
难度: 中等查看答案及解析
-
下列诗句、谚语或与化学现象有关,说法不正确的是
A. “水乳交融,火上浇油”前者包含物理变化,而后者包含化学变化
B. “落汤螃蟹着红袍”肯定发生了化学变化
C. “滴水石穿、绳锯木断”不包含化学变化
D. “看似风平浪静,实则暗流涌动”形象地描述了溶解平衡的状态
难度: 中等查看答案及解析
-
在给定条件下,下列选项中所示的物质间转化均能一步实现的是( )
A. 粗硅
SiCl4
Si
B. Mg(OH)2
MgCl2(aq)
Mg
C. Fe2O3
FeCl3(aq)
无水FeCl3
D. S
SO3
H2SO4
难度: 中等查看答案及解析
-
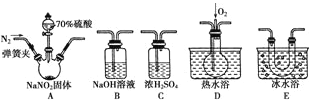
草酸晶体(H2C2O4·2H2O)100 ℃开始失水,101.5 ℃熔化,150 ℃左右分解产生H2O、CO和CO2。用加热草酸晶体的方法获取某些气体,应该选择的气体发生装置是(图中加热装置已略去)( )。
A.
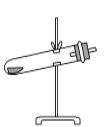 B.
B. 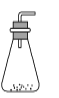 C.
C. 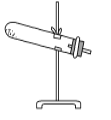 D.
D. 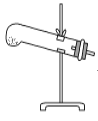
难度: 中等查看答案及解析
-
下图是印在食品包装内常见小袋子上的部分图案,该小袋子内的物质最有可能是( )

A. 铁粉 B. 氧化钠 C. 亚硫酸钠 D. 生石灰
难度: 简单查看答案及解析
-
下列解释事实的离子方程式正确的是
A. 铁和稀硝酸反应制得浅绿色溶液:Fe+4H++NO3-===Fe3++NO↑+2H2O
B. 实验室盛碱液的试剂瓶不用玻璃塞:SiO2+2OH-===SiO32-+H2O
C. 碳酸氢镁和足量的氢氧化钙溶液反应:Ca2++OH-+HCO3-===CaCO3↓+H2O
D. 向Ca(ClO)2溶液中通入过量CO2:2ClO-+H2O+CO2===2HClO+CO32-
难度: 简单查看答案及解析
-
下列有关铁元素的叙述中正确的是( )
A. Fe(OH)2易被氧化成Fe(OH)3,说明稳定性:Fe(OH)2<Fe(OH)3
B. 铁是较活泼的金属,它与卤素(X2)反应的生成物均为FeX3
C. 氢氧化铁与氢碘酸反应:Fe(OH)3+3HI=FeI3+3H2O
D. 将FeCl3饱和溶液滴入NaOH溶液中可制备Fe(OH)3胶体
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体,结论:HNO3分解成了NO2
B. 实验室检验氨气的方法是将湿润的蓝色石蕊试纸靠近瓶口或管口,观察试纸是否呈红色
C. 灼热的铂丝与NH3、O2混合气接触,铂丝继续保持红热,说明氨的氧化反应是放热反应
D. 浓硝酸有强氧化性,常温下能与Fe发生剧烈反应
难度: 中等查看答案及解析
-
下列选用的实验仪器或实验装置符合实验要求且安全的是( )
A. 实验室制备少量蒸馏水
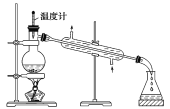 B. 实验室制备氨气
B. 实验室制备氨气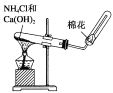
C. 实验室制备NO2
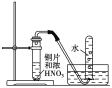 D. 实验室制备氢气
D. 实验室制备氢气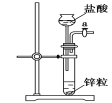
难度: 中等查看答案及解析
-
海水开发利用的部分过程如图所示。下列说法错误的是
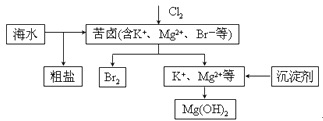
A. 向苦卤中通入Cl2是为了提取溴
B. 粗盐可采用除杂和重结晶等过程提纯
C. 工业生产中常选用NaOH作为沉淀剂
D. 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
难度: 中等查看答案及解析
-
下列曲线图(纵坐标为沉淀的量,横坐标为加入物质的量)与对应的选项相符合的是( )
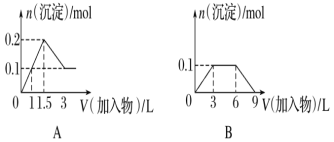
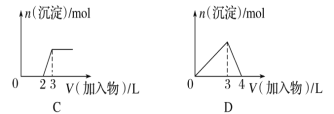
A. 向1 L浓度均为0.1 mol·L-1的Ba(OH)2、NaAlO2混合溶液中加入0.1 mol·L-1的稀H2SO4
B. 向1 L浓度分别为0.1 mol·L-1和0.3 mol·L-1的AlCl3、NH4Cl的混合溶液中加入0.1 mol·L-1的稀NaOH溶液
C. 向烧碱溶液中滴加明矾溶液
D. 向AlCl3溶液中滴加过量氨水
难度: 困难查看答案及解析
-
某铁的氧化物(FexO)1.52g溶于足量盐酸中,向所得溶液中通入标准状况下112mlCl2,恰好将Fe2+完全氧化。x值为( )
A. 0.80 B. 0.85 C. 0.90 D. 0.93
难度: 中等查看答案及解析