-
短周期主族元素X、Y、Z、W的原子序数依次增大,甲、乙分别是X、W两元素对应的单质,丙、丁是由这些元素组成的二元化合物,戊是Z的最高价氧化物对应的水化物,且25℃时0.1mol/L 戊溶液的pH为13,工业上通过电解丙和丁的混合物来制取甲、乙、戊。下列说法不正确的是( )
A. 原子半径:Z>W>Y>X
B. Z分别与X、Y、W形成的化合物中一定没有共价键
C. 元素Y与X、Z都能组成两种化合物
D. 乙与戊的水溶液反应后所得溶液具有漂白性
难度: 困难查看答案及解析
-
下表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是( )
选项
陈述Ⅰ
陈述Ⅱ
判断
A
碳酸钠溶液可用于治疗胃病
Na2CO3可与盐酸反应
Ⅰ对,Ⅱ对,有
B
向Na2O2的水溶液中滴酚酞变红色
Na2O2与水反应生成氢氧化钠
Ⅰ对,Ⅱ错,无
C
金属钠具有强还原性
高压钠灯发出透雾性强的黄光
Ⅰ对,Ⅱ对,有
D
过氧化钠可用于航天员的供氧
Na2O2能与CO2、H2O反应生成O2
Ⅰ对,Ⅱ对,有
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
化学在生产和日常生活中有重要的应用。下列说法中错误的是 ( )
A. MgO、Al2O3的熔点很高,可制作耐高温材料,工业上也用其电解冶炼对应的金属
B. 明矾水解形成的胶体能吸附水中悬浮物,可用于水的净化
C. 燃放的焰火是某些金属元素焰色反应所呈现出来的色彩
D. 铝比铁活泼,但铝制品比铁制品在空气中耐腐蚀
难度: 简单查看答案及解析
-
下列有关实验的操作、现象及原理均正确的是
A. 用玻璃棒蘸取NaClO溶液点在干燥的pH试纸上,试纸呈现蓝色,证明HClO是弱酸
B. 将一定量的FeCl3晶体、盐酸依次加入容量瓶中,配制一定物质的量浓度的FeCl3溶液
C. 为证明Cu与浓硫酸反应生成了CuSO4,可将反应后的混合液冷却后再加入水,若显蓝色即可证明生成了CuSO4
D. 用乙醇、乙酸及浓硫酸制取乙酸乙酯的过程中发现忘加碎瓷片,需在完全冷却后再补加
难度: 简单查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
A. 1L1.0mo1•L-1的NaAlO2水溶液中含有的氧原子数为2NA
B. 标准状况下,11.2 LNO与11.2LO2混合后所含分子数为0.75NA
C. Na2O和Na2O2混合物的物质的量为1mol,其中含有的阴离子总数为NA
D. 室温下,将9g铝片投入0.5L 18.4mol•L-1的H2SO4中,转移的电子数为NA
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A. 向水中通入氯气:Cl2+H2O===2H+ + ClO−+ Cl−
B. 向Ca(HCO3)2溶液中滴加足量NaOH溶液:Ca2+ + 2HCO3−+2OH−===CaCO3↓+CO32−+2H2O
C. 向明矾溶液中加过量氨水:Al3++4NH3·H2O===AlO2−+4NH4++2H2O
D. 将Fe2O3溶解与足量HI溶液:Fe2O3+6H+===2Fe3++3H2O
难度: 中等查看答案及解析
-
室温下,下列各组离子能大量共存的是
A. pH=7的溶液中:Fe3+、Mg2+、SO42-、Cl-
B. NaHS溶液中:SO42-、K+、Cl-、Cu2+
C. KW/c(H+)=10-13mol·L−1的溶液中:NH4+、Mg2+、SO42-
D. 通入大量CO2的溶液中:Na+、ClO-、CH3COO-、HCO3-
难度: 中等查看答案及解析
-
向含有c(FeCl3)=0.2mol·L−1、c(FeCl2)=0.1mol·L−1的混合溶液中滴加稀NaOH溶液,可得到一种黑色分散系,其中分散质粒子是直径约为9.3nm的金属氧化物,下列有关说法中正确的是
A. 该分散系的分散质为Fe2O3
B. 可用过滤的方法将黑色金属氧化物与Na+分离开
C. 向沸水中逐滴滴加0.1mol·L−1 FeCl3溶液也可得到Fe(OH)3胶体
D. 加入NaOH时发生的反应可能为Fe2++2Fe3++8OH-===Fe3O4+4H2O
难度: 中等查看答案及解析
-
铝土矿的主要成分是Al2O3、SiO2和Fe2O3等。从铝土矿中提炼Al2O3的流程
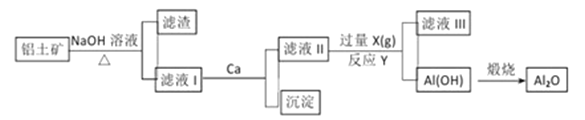
下列说法中错误的是
A. 滤液Ⅰ的主要成分是Na2SiO3、NaAlO2和NaOH
B. 滤液Ⅲ的含大量的阴离子是HCO3-
C. 反应Y的离子方程式是2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D. 滤液Ⅱ中通入过量的X的目的是使AlO2-充分沉淀而不引进杂质
难度: 中等查看答案及解析
-
利用右图所示装置进行下列实验,能得出相应实验结论的是( )
选项
①
②
③
实验结论
实验装置
A
稀硫酸
Na2S
AgNO3与AgCl的溶液
Ksp(AgCl)>Ksp(Ag2S)
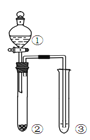
B
浓硫酸
蔗糖
溴水
浓硫酸具有脱水性、氧化性
C
稀盐酸
Na2SO3
Ba(NO3)2 溶液
SO2与可溶性钡盐均可以生成白色沉淀
D
浓硝酸
Na2CO3
Na2SiO3溶液
酸性:硝酸>碳酸>硅酸
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
铅丹(Pb3O4)可作防锈用涂料,已知铅丹中Pb元素的化合价只有+2、+4,且+2价稳定,+4价的Pb具有强氧化性,能氧化浓盐酸生成Cl2。则下列说法不正确的是 ( )
A. Pb3O4可表示为2PbO·PbO2
B. 可用PbO在空气中加热制备铅丹,其n(氧化剂):n(还原剂)=1:6
C. 0.1mol Pb3O4与足量的浓盐酸反应,生成Cl20.1 mol
D. a mol Pb3O4加强热分解生成PbO,则加热过程中转移电子数为2a NA
难度: 中等查看答案及解析
-
将一定质量的镁铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3 mol·L-1 NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g,则下列有关叙述中正确的是( )
A. 加入合金的质量不可能为6.4 g
B. 参加反应的硝酸的物质的量为0.1 mol
C. 沉淀完全时消耗NaOH溶液的体积为150 mL
D. 溶解合金时收集到NO气体的体积在标准状况下为2.24 L
难度: 困难查看答案及解析
-
X、Y、Z、W四种物质在一定条件下具有如图所示的转化关系,下列判断正确的是
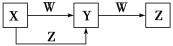
A. 若图中反应均为非氧化还原反应,当W为一元强碱时,则X可能是NaAlO2
B. 若图中反应均为非氧化还原反应,当W为一元强酸时,则X可能是NH3
C. 若图中反应均为氧化还原反应,当W为非金属单质时,则Z可能是CO2
D. 若图中反应均为氧化还原反应,当W为金属单质时,则Z可能是FeCl3
难度: 困难查看答案及解析
-
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
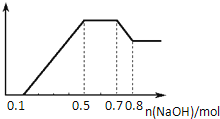
A. 溶液中一定不含CO32-,可能含有SO42-和NO3-
B. 溶液中n(NH4+)=0.2mol
C. 溶液中的阳离子只有H+、Mg2+、Al3+
D. n(H+):n(Al3+):n(Mg2+)=1:1:1
难度: 困难查看答案及解析
-
某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔材料.下列说法正确的是
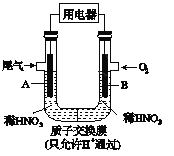
A. 电极A表面反应之一为NO2-e-+H2O= NO3_+2H+
B. 电极B附近的c(NO3_)增大
C. 电解质溶液中电流的方向由B到A,电子的流向与之相反
D. 该电池工作时,每转移4mol电子,消耗22.4L O2
难度: 中等查看答案及解析
-
若往20 mL 0.01 mol·L-1 HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示。下列有关说法不正确的是
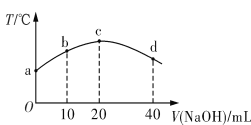
A. HNO2的电离平衡常数:c点>b点
B. b点混合溶液显酸性:c(Na+)>c(NO2-)>c(H+)>c(OH-)
C. c点混合溶液中:c(OH-)>c(HNO2)
D. d点混合溶液中:c(Na+)>c(OH-)>c(NO2-)>c(H+)
难度: 困难查看答案及解析
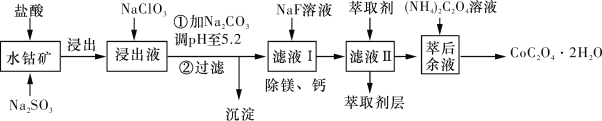

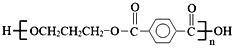 。合成M的一种途径如下:
。合成M的一种途径如下:
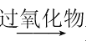 R-CH2CH2OH;④
R-CH2CH2OH;④ 。
。