-
2018年10月3日瑞典皇家科学院宣布,将授予美国科学家弗朗西斯·阿诺德(Frances H. Arnold)、美国科学家乔治·史密斯(George P. Smith)及英国科学家格雷戈里· 温特尔(Sir Gregory P. Winter)三位科学家2018诺贝尔化学奖,以表彰他们在酶的定向演化以及用于多肽和抗体的噬菌体展示技术方面取得的成果。在物质的分类上,酶属于
A. 单质 B. 无机物 C. 有机物 D. 氧化物
难度: 简单查看答案及解析
-
下列关于胶体和溶液的说法中,正确的是
A. 胶体和溶液均能导电
B. 胶体和溶液的本质区别是能否产生丁达尔效应
C. 明矾水解生成Al(OH)3胶体,可用作净水剂
D. 布朗运动是胶体粒子特有的运动方式,可以据此区分胶体与溶液
难度: 简单查看答案及解析
-
下列实验中,所选装置或实验设计合理的是
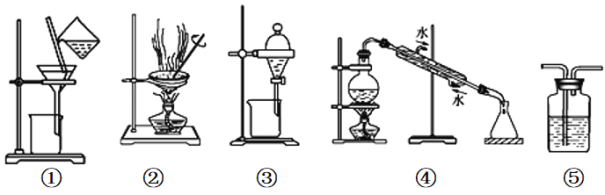
A. 用图①和②所示装置可以除去Na2CO3中的CaCO3杂质,并获得Na2CO3固体
B. 用乙醇提取溴水中的溴选择图③所示装置
C. 用图④所示装置可以分离乙醇水溶液
D. 图⑤所示装置中盛有饱和Na2SO3溶液除去SO2中含有的少量HCl
难度: 简单查看答案及解析
-
下列实验操作有错误的是
A. 过滤操作中,漏斗的尖端应接触烧杯内壁
B. 用焰色反应检验Na+ 时,用玻璃棒蘸取试样置于火焰上灼烧观察火焰颜色
C. 蒸馏中,冷却水应从冷凝管的下口通入,上口流出
D. 向容量瓶转移液体时,导流用的玻璃棒可以接触容量瓶内壁
难度: 简单查看答案及解析
-
下列说法不正确的是
A. 物质的量是用来衡量微观粒子多少的一种物理量
B. 在一定的温度和压强下,各种气体的摩尔体积相等
C. 阿伏加德罗常数的数值是0.012kg 12C所含的原子个数
D. 若气体摩尔体积为22.4L•mol-1,则所处条件必为标准状况
难度: 简单查看答案及解析
-
4克氧气含有x个氧原子,则阿伏加德罗常数为
A. x/4 B. 4x C. x/8 D. 8x
难度: 简单查看答案及解析
-
在标准状况下,相同体积的下列气体所含物质的质量最小的是
A. O2 B. N2 C. CO2 D. NH3
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,2.24 L H2和O2的混合气体中分子数为0.2 NA
B. 1L 0.1 mol·L-1碳酸钠溶液中含有的氧原子数为0.3 NA
C. 14g N2 和CO的混合气体中分子数为0.5 NA
D. 1L 0.1 mol·L-1盐酸中含有HCl分子数为0.1 NA
难度: 简单查看答案及解析
-
下列溶液中c(Cl-)与100 mL 1 mol/L CaCl2的溶液中的c(Cl-)相等的是
A. 100 mL 2 mol/L NaCl溶液 B. 100 mL 2 mol/L MgCl2溶液
C. 50 mL 4 mol/L KCl溶液 D. 100 mL 1 mol/L AlCl3溶液
难度: 简单查看答案及解析
-
下列溶液中物质的量浓度为1 mol·L-1的是( )
A. 将40 g NaOH固体溶解于1 L水中
B. 将22.4 L氯化氢气体溶于水,配成1 L溶液
C. 将1 L 10 mol·L-1的浓盐酸与9 L水混合
D. 10 g NaOH固体溶解在水中,配制成250 mL溶液
难度: 简单查看答案及解析
-
下列说法正确的是
A. CO2和SO2的水溶液能够导电,所以CO2和SO2属于电解质
B. BaSO4在水中的溶解度很小,属于弱电解质
C. 弱电解质溶液的导电能力也可以比强电解质溶液的导电能力强
D. 弱电解质的溶解度小于强电解质的溶解度
难度: 简单查看答案及解析
-
水溶液中能大量共存的一组离子是
A. NH4+、Ba2+、Br-、CO32- B. K+、Na+、SO42-、MnO4-
C. Cl-、SO32-、Fe2+、H+ D. Na+、Ca2+、Cl-、SO42-
难度: 简单查看答案及解析
-
下列反应可用离子方程式H++OH−=H2O表示的是
A. NaHSO4溶液与NaOH溶液混合 B. H2SO4溶液与Ba(OH)2溶液混合
C. NaHCO3溶液与KOH溶液混合 D. NH4Cl溶液与NaOH溶液混合
难度: 简单查看答案及解析
-
下列离子方程式正确的是
A. 铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
B. 用氢氧化钠溶液吸收过量二氧化碳气体:CO2 +OH-=HCO3-
C. 碳酸氢钠溶液和少量的澄清石灰水混合:HCO3-+Ca2++OH-=CaCO3↓+H2O
D. 醋酸除去水垢:2H+ +CaCO3=Ca2++CO2↑+H2O
难度: 简单查看答案及解析