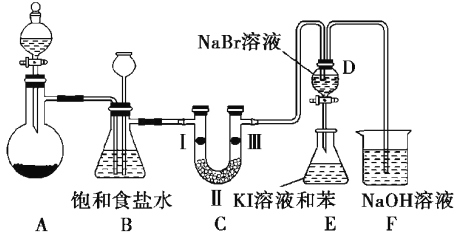
-
C和CuO在一定温度下反应,产物有Cu、Cu2O、CO、CO2。若将2.00 g C跟16.0 g CuO混合,隔绝空气加热,将生成的气体全部通过足量的澄清石灰水,反应一段时间后共收集到1.12 L气体(标准状况),生成沉淀的质量为5.00 g。下列说法错误的是
A. 反应后的固体混合物中还含有碳
B. 反应后的固体混合物中氧化物的物质的量为0.05 mol
C. 反应后的固体混合物中Cu的质量为12.8 g
D. 反应后的固体混合物总质量为14.4 g
难度: 中等查看答案及解析
-
短周期元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是
A. 质子数:c>d B. 原子半径:X<W
C. 离子的还原性:Y2->Z- D. 氢化物的稳定性:H2Y>HZ
难度: 中等查看答案及解析
-
下列有关文献记载中涉及的化学知识表述不正确的是
A. “以曾青涂铁,铁赤色如铜”说明我国古代就掌握了“湿法冶金”技术
B. “墙塌压糖,去土而糖白”中的脱色过程发生了化学变化
C. “丹砂烧之成水银,积变又还成丹砂”讲的是单质与化合物之间的互变
D. “煤饼烧蛎房成灰(蛎房即牡蛎壳)”中灰的主要成分为氧化钙
难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数的值,下列说法不正确的是
A. 5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.2NA
B. 1 mol的甲基与1 mol的氢氧根离子所含质子数均为9NA
C. 7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA
D. 60g熔融的NaHSO4化合物中含有的离子键数目为0.5NA
难度: 中等查看答案及解析
-
化学在生产、生活中有着重要用途,下列物质用途及对应解释都正确的是
选项
物质
用途
解释
A
浓H2SO4
干燥剂
浓H2SO4有脱水性
B
SiO2
光导纤维
SiO2是一种良好的半导体
C
Fe3O4
红色涂料
Fe3O4是一种红色氧化物
D
Al2O3
耐火材料
Al2O3的熔沸点较高
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
N2O(笑气)、CHCl3(氯仿)都曾在医学上被用作麻醉剂。下列说法正确的是
A. N2O、CHCl3都易溶于水 B. N2O、CHCl3都常温下都是气体
C. N2O、CHCl3都属于弱电解质 D. N2O、CHCl3都是非电解质
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A. 用稀硝酸溶解FeS固体:FeS + 2H+ = Fe2+ + H2S↑
B. 氢氧化铁溶液氢碘酸溶液:Fe(OH)3 + 6HI = Fe2+ + I2 + 4I- + 3H2O
C. 二氧化碳通入饱和的碳酸钠溶液:CO32- + CO2 + H2O = 2HCO3-
D. 向含0.4molFeBr2溶液通入0.3molCl2充分反应:4Fe2+ + 2Br- + 3Cl2 =4Fe3+ + 6Cl- + Br2
难度: 中等查看答案及解析
-
下列叙述正确的是
A. 等量的氯气分别与足量氢氧化钠和硫化钠充分反应,转移的电子数相同
B. 等量的铜分别与足量浓、稀硝酸充分反应,生成气体的物质的量相同
C. 等量的铝分别与氢氧化钠溶液和盐酸充分反应,生成气体体积一定相同
D. 等量的铁分别与足量氯气和硫充分反应,生成物质的物质的量相同
难度: 中等查看答案及解析
-
某化合物由两种单质直接反应生成,将其加入Ba(HCO3)2溶液中同时有气体和沉淀产生.下列化合物中不符合上述条件的是
A. Na2O2 B. SO2 C. SO3 D. AlCl3
难度: 中等查看答案及解析
-
X、Y、Z、W、M为短周期主族元素,25°C时,其最高价氧化物对应的水化物(浓度均为 0.01mol·L-1)溶液的pH和原子半径的关系如图所示。下列有关说法不正确的是
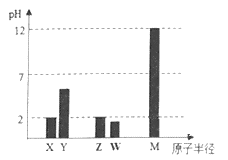
A. 最简单气态氢化物的热稳定性:Z>W
B. Y的最高价氧化物的电子式为:
C. W的气态氢化物是强酸
D. X、M两种元素形成的简单离子半径大小顺序:X>M
难度: 中等查看答案及解析
-
某溶液中可能含有等物质的量浓度的K+、Na+、Fe3+、Fe2+、SO42-、SO32-、I-、NO3-中的几种离子,为了确定其组成,某同学取两份该溶液进行了如下实验(1)一份滴入氯化钡固体,产生不溶于水的沉淀;(2)一份加入酸性高锰酸钾溶液,发现高锰酸钾溶液褪色。下列说法不正确的是
A. 可能含有SO32- B. 可能含有SO42-
C. 可能含有Fe2+ D. 可能含有Fe3+
难度: 中等查看答案及解析
-
向物质的量各有1mol的NH4Al(SO4)2和H2SO4混合稀溶液中逐滴加入一定量Ba(OH)2溶液,产生沉淀的量随着Ba(OH)2 加入量的变化如图所示。下列离子方程式书写正确的是
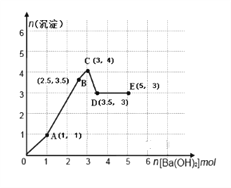
A. O→A:H++SO42-+Ba2++OH-=BaSO4↓+H2O
B. A→B:2Al3++3SO42-+3Ba2+ +6OH-=3BaSO4↓+2Al(OH)3↓
C. B→C:NH4++SO42-+Ba2+ +OH-=BaSO4↓+NH3·H2O
D. D→E:NH4++ OH-=NH3·H2O
难度: 中等查看答案及解析
-
下列说法不正确的是(涉及溶液体积变化均忽略不计)
A. 向Na2CO3溶液中逐滴加入HCl,直到不再生成CO2气体为止,在此过程中,溶液中的HCO3-浓度变化是先变大后变小
B. 有含0.2 mol Na2CO3和含0.3 mol HCl的两种溶液:①将Na2CO3溶液逐滴滴入HCl溶液中;②将HCl溶液逐滴滴入Na2CO3溶液中;①②两种操作生成的CO2体积之比为3∶2
C. 将等质量的Na2O和Na2O2样品分别放入等量的水中,所得溶液的质量分数分别为a%和b%,则a=b
D. 将物质的量Na2O和Na2O2分别放入等量的水中,所得溶液的物质的量浓度为c1和c2,则c1=c2
难度: 困难查看答案及解析
-
某强酸性溶液X可能含有Fe2+、A13+、NH4+、CO32-、SO32-、SO42-、C1-中的若干种,现取X溶液进行连续实验,实验过程及产物如图.说法正确的是
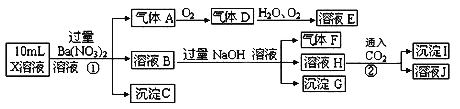
A. X中肯定存在Fe2+、A13+、NH4+、SO42- B. X中不能确定的离子是 A13+和C1-
C. 沉淀I一定是Al(OH)3 D. 溶液E和气体F不能发生化学反应
难度: 中等查看答案及解析
-
已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:Fe3+→Fe2+;MnO4-→Mn2+;Cl2→2Cl-;IO3-→I2。如果分别用等物质的量的这些物质氧化足量的KI,则得到I2最多的是
A. Cl2 B. IO3- C. Fe3+ D. MnO4-
难度: 中等查看答案及解析
-
向含1mol HCl和1mol MgSO4的混合溶液中加入1mol·L—1的Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图正确的是( )
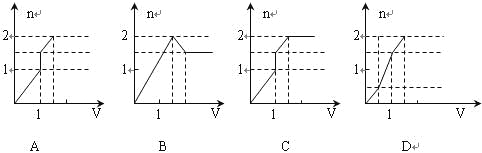
难度: 简单查看答案及解析