-
下列说法正确的是
A. HD、CuSO4·5H2O都是化合物
B. 由同种元素组成的物质一定是纯净物
C. NaHSO4在溶液中能电离出H+,所以NaHSO4是酸
D. 浊液、胶体、溶液三种分散系的本质区别是分散质微粒直径的大小不同
难度: 中等查看答案及解析
-
向含有FeBr2、FeI2的溶液中缓缓通入一定量的氯气后,再向溶液中滴加KSCN溶液,溶液变 为血红色,若只从反应顺序角度考虑反应情况,则下列叙述不正确的是( )
A. 通入氯气后的溶液中一定不存在I-
B. 通入氯气之后原溶液中的Fe2+全部被氧化
C. 原溶液中的Br-可能被氧化
D. 若取少量所得溶液,再加入CCl4溶液充分振荡,静置、分液,下层溶液可能呈紫红色
难度: 困难查看答案及解析
-
下列各组物项相互混合进行反应,既有气体生成最终又有沉淀生成的是( )
① 金属钠投入FeCl2溶液中
② 过量的NaOH溶液和明矾溶液反应
③ 少量CaO投入过量的NaHCO3溶液中
④Na2O2投入到CuSO4溶液中
A. ①③ B. ③④ C. ①④ D. ②③
难度: 简单查看答案及解析
-
有关Na2CO3和NaHCO3的性质,下列叙述错误的是
A. 相同温度下,等浓度的Na2CO3和NaHCO3溶液的碱性比较,前者更强
B. 常温时水溶性:Na2CO3>NaHCO3
C. 在酒精灯加热的条件下,前者不分解,后者分解
D. 将澄清石灰水分别加入Na2CO3和NaHCO3溶液中,前者产生沉淀,后者无现象
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 1 mol Cl2与足量Fe反应转移电子数一定为3NA
B. 含4 mol HCl的浓盐酸与足量的MnO2反应有2mol电子转移
C. 1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA
D. 标准状况下,22.4 L氨水含有NA个NH3分子
难度: 中等查看答案及解析
-
在5NH4NO3
2HNO3+4N2↑+9H2O反应中,氧化剂与还原剂物质的量之比是
A. 5∶8 B. 5∶4 C. 5∶3 D. 3∶5
难度: 中等查看答案及解析
-
下列反应的离子方程式书写不正确的是
A. 铝与氢氧化钠溶液:2Al+2OH-+2H2O=2AlO2—+3H2↑
B. 向硅酸钠溶液中加入盐酸:SiO32—+2H+=H2SiO3(胶体)
C. 二氧化氮和水的反应:2NO2+H2O=2H++NO3—+NO
D. 电解饱和食盐水:2Cl-+2H2O
2OH-+H2↑+Cl2↑
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍。下列判断正确的是( )
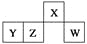
A. 原子半径:rW>rZ>rY>rX
B. 含Y元素的盐溶液显酸性
C. 最简单气态氢化物的热稳定性:Z>W
D. X与氢元素组成的化合物XH5与水反应可产生两种气体
难度: 中等查看答案及解析
-
甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化)。下列各组物质中,不能满足图示转化关系的是
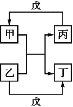
甲
乙
丙
戊
A
Cu
FeCl3溶液
CuCl2溶液
Fe
B
H2O
Fe
H2
O2
C
Al
NaOH溶液
H2
Al2O3
D
CH3CH2OH
O2
CH3CHO
H2
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
有下列三个反应:
①Cl2+FeI2=FeCl2+I2
②2Fe2++Br2=2Fe3++2Br-
③Co2O3+6HCl=2CoCl2+Cl2↑+3H2O
下列说法正确的是( )
A. 反应①②③中的氧化产物分别是I2、Fe3+、CoCl2
B. 根据以上方程式可以得到氧化性:Cl2>Fe3+>Co2O3
C. 在反应③中当1 mol Co2O3参加反应时,2 mol HCl被氧化
D. 可以推理得到Cl2+FeBr2 =FeCl2+Br2
难度: 中等查看答案及解析
-
向含 Na+、 Al3+、 Fe3+、 Fe2+、 Cl﹣、 SO42﹣的水溶液中,加入足量的 Na2O2 固体,充分反应后再加入过量的稀盐酸,所得溶液与起始溶液相比,上述离子数目没有变化的有( )
A. 2 种 B. 3 种 C. 4 种 D. 5 种
难度: 困难查看答案及解析
-
下列物质之间的转化在给定条件下能实现的是
①S
SO2
BaSO4
②CuSO4(aq)
Cu(OH)2悬浊液
Cu2O
③饱和NaCl(aq)
NaHCO3
Na2CO3
④Fe2O3
FeCl3(aq)
无水FeCl3
A. ①③ B. ②③ C. ②④ D. ①④
难度: 中等查看答案及解析
-
下列关于镁铝化学性质的表述不正确的是
铝
镁
A.与非金属反应
能被Cl2、O2氧化
能与N2、O2反应
B.与水反应
常温下难与水反应
常温下能与水缓慢反应
C.与碱反应
能溶于碱溶液
能溶于碱溶液
D.与某些氧化物反应
能与Fe2O3、MnO2、Co2O3等金属氧化物发生铝热反应
能在CO2中燃烧
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
用铝制易拉罐收集满CO2,加入过量NaOH浓溶液,立即把口封闭。发现易拉罐“咔咔”作响并变瘪了,过了一会儿,易拉罐又会作响并鼓起来,下列说法正确的是
A. 导致易拉罐变瘪的离子反应是CO2+OH-=HCO3-
B. 导致易拉罐又鼓起来的反应是:Al3++3HCO3-=Al(OH)3↓+3CO2↑
C. 上述过程中共发生了三个化学反应,且反应结束后的溶液呈碱性
D. 若将CO2换为NH3,浓NaOH溶液换为水,易拉罐也会出现先瘪后鼓的现象
难度: 中等查看答案及解析
-
下列有关离子组的评价及相关离子方程式均正确的是( )
选项
离子组
评价及离子方程式
A
H+、Fe2+、NO3-、Cl-
不能大量共存于同一溶液中,因为发生反应:Fe2++2H+=Fe3++ H2↑
B
Na+、K+、HCO3-、OH-
不能大量共存于同一溶液中,因为发生反应:HCO3-+ OH-=H2O+CO2↑
C
Ca2+、NH4+、CO32-、Cl-
能大量共存于同一溶液中
D
Na+、NH4+、SO42-、Cl-
能大量共存于同一溶液中
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列说法在一定条件下可以实现的有( )
①酸性氧化物与碱发生反应生成酸式盐 ②弱酸与盐溶液反应可以生成强酸 ③没有水生成,也没有沉淀和气体生成的复分解反应 ④两种酸溶液充分反应后的溶液体系为中性 ⑤有单质参加的非氧化还原反应 ⑥两种氧化物反应的产物有气体
A. 6个 B. 5个 C. 4个 D. 3个
难度: 中等查看答案及解析
-
在下列各溶液中,离子一定能大量共存的是
A. 室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42—
B. 0.1 mol·L-1FeCl3溶液中:Fe2+、NH4+、SCN-、SO42—
C. 加入铝粉有气泡产生的溶液中:Na+、NH4+、Fe2+、NO3-
D. 在NaAlO2 溶液中:K+、Na+、HCO3-、SO42—
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A. 钠与水反应:Na+2H2O
Na++2OH-+H2↑
B. 电解饱和食盐水获取烧碱和氯气:2Cl-+2H2O
H2↑+Cl2↑+2OH-
C. 向氢氧化钡溶液中加入稀硫酸:Ba2++OH-+H++S
BaSO4↓+H2O
D. 碳酸钡和稀硝酸反应:C
+2H+
CO2↑+H2O
难度: 中等查看答案及解析
-
下列物质的电子式书写正确的是①Ca(OH)2
②H2S
③OH-
④Al3+ Al3+⑤N2
⑥CO2
⑦HClO
⑧Na2O2
A. ①②③④ B. ⑤⑥⑦⑧ C. ①④⑧ D. ②③⑤⑥⑦
难度: 中等查看答案及解析
-
下列各组离子,在指定条件下,一定能大量共存的是
①某无色透明的酸性溶液中:Cl-、Na+、AlO2—、SO42—
②水电离产生的c(H+)=10-12 mol·L-1的溶液中:K+、Ba2+、Cl-、NO3—
③使紫色石蕊试液变红的溶液中:Fe2+、Mg2+、NO3—、Cl-
④饱和氯水中:Cl-、NO3—、Na+、SO32—
⑤能使甲基橙呈黄色的溶液中:K+、SO32—、SO42—、NO3—
⑥在酸性高锰酸钾溶液中:Na+、NH4+、I-、ClO-
⑦能使pH试纸变深蓝色的溶液中:Na+、AlO2—、K+、CO32—
⑧在FeCl2溶液中:K+、Na+、SO42—、AlO2—
A. ①③④⑥⑦ B. ②⑤⑧ C. ②⑦ D. ②④⑧
难度: 中等查看答案及解析
-
铜和镁的合金2.14 g完全溶于一定浓度的硝酸,若反应中硝酸被还原为NO2、NO、N2O三种气体,且在标准状况下的体积均为0.224 L,在反应后的溶液中,加入足量的氢氧化钠溶液,生成的沉淀经过滤、洗涤、干燥后称量,其质量为
A. 3.12 g B. 4.18 g C. 4.62 g D. 5.06 g
难度: 中等查看答案及解析
-
下列物质在给定条件下能实现转化的是
①Si
Na2SiO3(aq)
H2SiO3
②Na
Na2O2
NaOH
③CaCO3
CaO
CaC2
C2H4
④饱和NaCl(aq)
NaHCO3
Na2CO3
⑤MgCl2(aq)
MgCl2·6H2O
Mg
⑥CuSO4(aq)
Cu(OH)2
Cu2O
A. ①④⑥ B. ③④⑤
C. ②⑤⑥ D. ①②③
难度: 中等查看答案及解析
-
下列结论中错误的是
①微粒半径:K+>Al3+>Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:F->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO
⑥非金属性:O>N>P>Si⑦金属性:Be<Mg<Ca<K
A. ① B. ①③ C. ②④⑤⑥⑦ D. ①③⑤
难度: 中等查看答案及解析
-
某溶液中可能含有H+、Mg2+、NH4+、Al3+、Fe3+、CO32—、SO42—、NO3—中的几种。若加入锌粒,产生无色无味的气体;若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法不正确的是
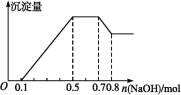
A. 溶液中的阳离子有H+、Mg2+、NH4+、Al3+
B. 溶液中n(Al3+)=0.1 mol
C. 溶液中一定不含CO32—,可能含有SO42—和NO3—
D. n(H+)∶n(Al3+)∶n(Mg2+)=2∶2∶1
难度: 中等查看答案及解析