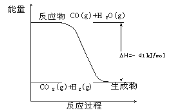
-
下列试剂中,能用于鉴别甲烷和乙烯的是
A. 水 B. 稀硫酸
C. 氢氧化钠溶液 D. 酸性高锰酸钾溶液
难度: 中等查看答案及解析
-
下列物质中,既含有离子键又含有共价键的化合物是
A. CaCl2 B. Na2O2 C. K2O D. C2H5OH
难度: 简单查看答案及解析
-
下列变化中与原电池反应的有关的是
A. 金属铁、铝在冷的浓硫酸中钝化
B. 在空气中金属铝表面迅速被氧化形成保护膜
C. 红热的铁丝与水接触表面形成蓝色保护层
D. 在铁与稀H2SO4反应时,加几滴CuSO4溶液,可加快H2的产生
难度: 简单查看答案及解析
-
一种“即食即热型快餐”适合外出旅行时使用。其内层是用铝箔包裹的、并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两种化学物质反应,此时便可对食物进行加热,这两包化学物质最合适的选择是( )
A. 浓硫酸与水 B. 生石灰与水 C. 熟石灰与水 D. 氯化钠与水
难度: 中等查看答案及解析
-
氧元素有多种核素,其中核素
的中子数是
A. 8 B. 10 C. 18 D. 26
难度: 中等查看答案及解析
-
下列物质中,属于高分子化合物的是
A. 蛋白质 B. 油脂 C. 葡萄糖 D. 蔗糖
难度: 中等查看答案及解析
-
下列属于酸性食物的是
A. 苹果 B. 西瓜 C. 梨 D. 鸡肉
难度: 简单查看答案及解析
-
下图中表示吸热反应的是
A.
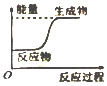 B.
B. 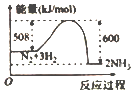
C.
 D.
D. 
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是
A. 氯化钠的分子式:NaCl
B. 硫原子的结构示意图 :
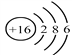
C. 过氧化钠的电子式:
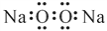
D. 中子数为10的氧原子:108O
难度: 简单查看答案及解析
-
下列物质中常用作食品防腐剂的是
A. 福尔马林 B. 甲酸 C. 亚硝酸钠 D. 乙醇
难度: 中等查看答案及解析
-
下列金属的冶炼原理中,属于热分解法的是:
A. 2HgO
2Hg+O2 B. Fe3O4+4CO
3Fe+4CO2
C. Fe+CuSO4 =Cu+FeSO4 D. 2NaCl(熔融)
2Na+Cl2↑
难度: 中等查看答案及解析
-
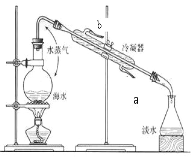
图为氢氧燃料电池的装置示意图,下列说法正确的是
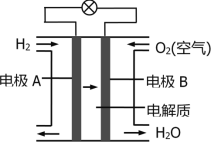
A. 该装置能将化学能转化为电能
B. 通入氧气的电极为负极
C. 电子由电极B经导线流向电极A
D. 正极反应式为:H2 – 2e- = 2H+
难度: 中等查看答案及解析
-
在铁与稀硫酸的反应中,已知10 min末硫酸的浓度减少了0.6 mol/L,若不考虑反应过程中溶液体积的变化,则10 min内消耗硫酸平均反应速率是
A. 0.6mol/(L•min)-1 B. 1.8mol/(L•min)-1
C. 0.06 mol/(L•min) D. 0.18 mol/(L•min)-1
难度: 中等查看答案及解析
-
下列物质既能与盐酸反应又能与氢氧化钠溶液反应的是
A. 碳酸钠 B. 金属铝 C. 硝酸钠 D. 氯化钠
难度: 中等查看答案及解析
-
铁元素在地壳中的含量丰富。关于铁及其化合物的说法错误的是
A. 钢属于铁合金 B. Fe2O3常用作红色油漆的原料
C. Fe(OH)3易溶于水 D. Fe3O4是具有磁性的黑色晶体
难度: 简单查看答案及解析
-
下列反应属于取代反应的是( )
A. CH4+2O2
CO2+2H2O
B. NaOH+HCl===NaCl+H2O
C. CH2=CH2+H2
CH3—CH3
D. CH4+Cl2
CH3Cl+HCl
难度: 简单查看答案及解析
-
在工业上合成氨反应:N2+3H2
2NH3 ,欲增大反应速率,下列措施可行的是:
A.降低温度 B.减小压强 C.减小H2的浓度 D.使用催化剂
难度: 中等查看答案及解析
-
下列物质中,不属于大气污染物的是
A. N2 B. NO2 C. SO2 D. CO
难度: 中等查看答案及解析
-
食物中的营养素有糖类、油脂、蛋白质等有机化合物,下列说法错误的是
A. “地沟油”的主要成分是油脂,可放心使用
B. 淀粉遇碘变蓝
C. 蛋白质在酶的催化下水解生成氨基酸
D. 葡萄糖在一定条件下,能与银氨溶液反应析出银
难度: 中等查看答案及解析
-
利用金属活泼性的不同,可以采用不同的冶炼方法。工业冶炼铝常采用
A. 热分解法 B. 电解法 C. 热还原法 D. 萃取法
难度: 中等查看答案及解析
-
下列各组物质中,互为同分异构体的是
A. O2和O3
B. CH3CH3和CH2=CH2
C.
和
D. CH3CH2CH2CH2 CH3和(CH3)2CH CH2CH3
难度: 中等查看答案及解析
-
下列离子方程式中,正确的是
A. 稀盐酸滴在铜片上:Cu + 2H+ = Cu2+ + H2↑
B. 稀盐酸滴在石灰石上:CO32— + 2H+= H2O + CO2↑
C. 稀盐酸滴入氢氧化钠中:H+ + OH-- = H2O
D. 铁片插入硫酸铜溶液中:Fe + Cu2+ = Fe3+ + Cu
难度: 中等查看答案及解析