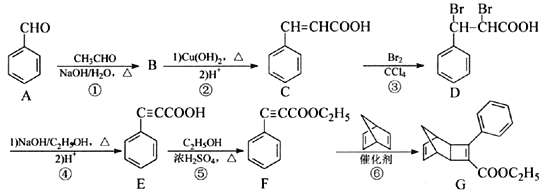
-
下列有关物质的性质与用途具有对应关系的是
A. 碳酸钠溶液具有碱性,可用于治疗胃酸过多
B. 氧化镁熔点高,可用于制造耐火材料
C. 氧化铁能与酸反应,可用于制作红色涂料
D. 氯化铁溶液呈酸性,可用于蚀刻铜电路板
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A. 0.1 mol丙烯酸中含有的双键数目为0.1 NA
B. 常温常压下,4.6 g NO2和N2O4的混合气体中分子总数为0.3 NA
C. 标准状况下,2.24LCCl4中含有的共价键数目为0.4NA
D. 7.8 g Na2O2和Na2S的固体混合物中含有的离子总数为0.3 NA
难度: 中等查看答案及解析
-
下列有关物质性质的叙述一定正确的是
A. 向淀粉溶液中滴加碘化钾溶液,溶液显蓝色
B. 向FeSO4溶液中滴加NH4SCN溶液,溶液显红色
C. 常温下,Al、Fe遇浓硫酸或浓硝酸发生钝化
D. 蔗糖与银氨溶液在水浴加热条件下可发生银镜反应
难度: 中等查看答案及解析
-
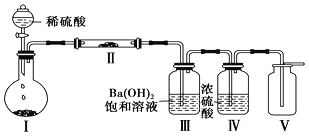
实验室将NH3通入AlCl3溶液中制备Al(OH)3,经过滤、洗涤、灼烧得Al2O3,下列图示装置和原理均能达到实验目的是( )
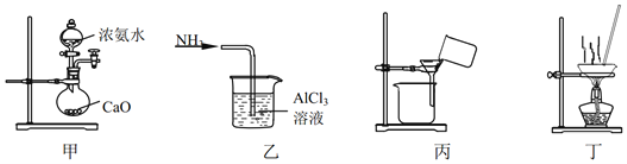
A. 用装置甲制取NH3 B. 用装置乙制备Al(OH)3
C. 用装置丙过滤并洗涤Al(OH)3 D. 用装置丁灼烧Al(OH)3得Al2O3
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A. 硅酸钠溶液与盐酸的反应:Na2SiO3+2H+===H2SiO3↓+2Na+
B. 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O===3I2+6OH-
C. 饱和Na2CO3溶液与CaSO4固体反应:CO32−+CaSO4
CaCO3+SO42−
D. 向NaHCO3溶液中滴加少量Ba(OH)2溶液:Ba2++OH-+HCO3—===BaCO3↓+H2O
难度: 中等查看答案及解析
-
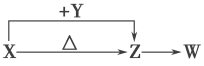
在给定的条件下,下列选项所示的物质间转化均能实现的是
A. Na
Na2O2
NaOH
B. MgCO3
MgCl2(aq)
Mg
C. Fe
Al
H2
D. C6H5ONa
C6H5OH
CO2
难度: 中等查看答案及解析
-
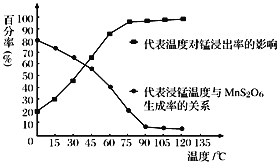
下列有关图像的说法正确的是
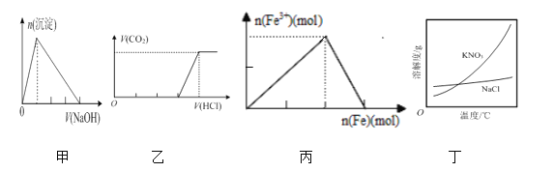
A. 图甲表示:向某明矾溶液中滴加过量的NaOH溶液,生成沉淀的物质的量与滴加NaOH溶液体积的关系
B. 图乙表示:向含等物质的量的NaOH和Na2CO3的混合溶液中滴加过量的稀盐酸,生成气体的体积与滴加HCl溶液体积的关系
C. 图丙表示:在稀硝酸溶液中加入过量的铁粉,溶液中Fe3+物质的量与加入铁粉物质的量的变化关系
D. 根据图丁,除去混在KNO3中少量的NaCl可用“蒸发浓缩、趁热过滤”的方法
难度: 中等查看答案及解析
-
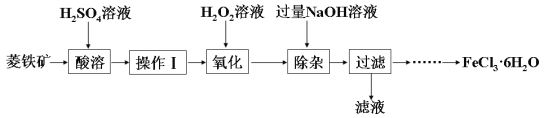
孔雀石的主要成分是Cu2(OH)2CO3(含Fe2O3、FeCO3、Al2O3、SiO2杂质),工业上用孔雀石制备硫酸铜的第一步需用过量的硫酸溶解并过滤。常温下,分别取滤液并向其中加入指定物质,反应后的溶液中大量存在的离子组正确的是
A. 加入过量氨水:Fe3+、NH4+、SO42-、OH-
B. 加入过量NaClO溶液:Fe2+、Na+、ClO-、SO42-
C. 加入过量NaOH溶液:Na+、AlO2-、SO42-、OH-
D. 加入过量NaHCO3溶液:Na+、Al3+、SO42-、HCO3-
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得到的结论正确的是
选项
实验操作和现象
结论
A
向硅酸钠溶液中滴加盐酸,有白色胶状沉淀生成
非金属性:C1>Si
B
某溶液中加入硝酸酸化的Ba(NO3)2溶液,无现象,再滴加AgNO3溶液,有白色沉淀生成
溶液中一定含有Cl-
C
淀粉溶液在硫酸存在下加热一段时间后,再与新制的Cu(OH)2悬浊液混合,加热煮沸,无红色沉淀生成
淀粉没有水解
D
向FeCl2溶液中加入足量Na2O2粉末,出现红褐色沉淀和无色气体
FeCl2溶液部分变质
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
化学与社会、生活密切相关。下列有关说法错误的是
A. 雾霾所形成的气溶胶有丁达尔效应
B. 臭氧的还原性使细菌的蛋白质变性
C. 实验“煤改气”“煤改电”等清洁燃料改造工程,有利于保护环境
D. “乙醇汽油”是向汽油中添加了一定比例的乙醇,该混合燃料的热值也发生了改变
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A. H2S的电子式:
B. 对硝基甲苯:
C. 氧离子的结构示意图:
D. 质子数为53,中子数为74的碘原子:
I
难度: 简单查看答案及解析