-
写出下列物质的电离方程式。
(1)NaHCO3 _______________________________;
(2)H2SO4 _______________________________;
(3)NaOH _______________________________;
(4)NaHSO4 _______________________________。
难度: 简单查看答案及解析
-
在标准状况下,①6g H2 ②11.2L O2 ③1mol NH3中,物质的量最大的是________,(填序号,下同)所含分子数最多的是___________,含原子数最多的是________,质量最大的是________,体积最小的是____。
难度: 简单查看答案及解析
-
为除去粗盐中的Ca2+. Mg2+. SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
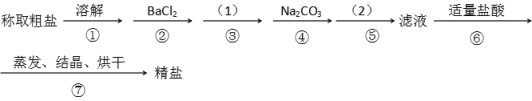
(1)第④步中,写出相应的离子方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2)_______________ ;____________。
(2)实验方案的(1)中应使用除杂试剂的化学式__________,发生的离子方程式是__________,在实验方案的(2)中的操作名称是_______。
(3)从实验设计方案优化的角度分析步骤②和④可否颠倒____________(填“是”或“否”,如果“否”,请说明理由。___________________________________________;
(4)判断BaCl2已过量的方法是_________________________________________________。
难度: 中等查看答案及解析
-
现用18.4 mol/L的浓H2SO4来配制500 mL 0.2 mol/L的稀H2SO4。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥托盘天平 ⑦药匙。
请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时不需要使用的有___________(填代号),还缺少的仪器是_______。
(2)经计算,需浓H2SO4的体积为___________,量取浓硫酸时应选用___________(选填①10 mL.②50 mL.③100 mL三种规格)的量筒。
难度: 简单查看答案及解析
-
乙酸是实验室常用的一种化学试剂,某乙酸试剂瓶上标签的部分内容如右图所示。利用标签提供的信息,回答下列问题:
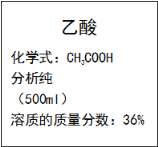
(1)乙酸的摩尔质量为______________。
(2)若该乙酸溶液的密度为1.02g/cm3,求此乙酸溶液的物质的量浓度_______。
难度: 简单查看答案及解析