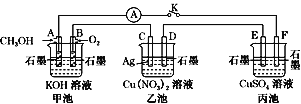
-
相同温度下,根据三种酸的电离常数,下列判断正确的是( )
酸
HX
HY
HZ
电离常数K
9×10-7
9×10-6
1×10-2
A. 三种酸的强弱关系:HX>HY>HZ
B. 反应HZ+Y-===HY+Z-能够发生
C. 相同温度下,0.1 mol·L-1的NaX、NaY、NaZ溶液,NaZ溶液pH最大
D. 相同温度下,1 mol·L-1 HX溶液的电离常数大于0.1 mol·L-1 HX
难度: 简单查看答案及解析
-
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:CH3CH2OH – 4e-+ H2O = CH3COOH + 4H+。下列有关说法正确的是
A. 检测时,电解质溶液中的H+向负极移动
B. 若有0.4mol电子转移,则在标准状况下消耗4.48L氧气
C. 电池反应的化学方程式为:CH3CH2OH + O2= CH3COOH + H2O
D. 正极上发生的反应为:O2+ 4e-+ 2H2O = 4OH-
难度: 中等查看答案及解析
-
黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:
S(s)+2KNO3(s)+3C(s)==K2S(s)+N2(g)+3CO2(g) ΔH=" x" kJ·mol-1
已知硫的燃烧热ΔH1=" a" kJ·mol-1
S(s)+2K(s)==K2S(s) ΔH2=" b" kJ·mol-1
2K(s)+N2(g)+3O2(g)==2KNO3(s) ΔH3=" c" kJ·mol-1
则x为
A. 3a+b-c B. c +3a-b C. a+b-c D. c+a-b
难度: 中等查看答案及解析
-
氢能是一种既高效又干净的新能源,发展前景良好,用氢作能源的燃料电池汽车备受青睐。我国拥有完全自主知识产权的氢燃料电池轿车“超越三号”,已达到世界先进水平,并加快向产业化的目标迈进。氢能具有的优点包括( )
①原料来源广 ②易燃烧、热值高 ③储存方便 ④制备工艺廉价易行
A. ①② B. ①③ C. ③④ D. ②④
难度: 简单查看答案及解析
-
标准状态下,气态分子断开1 mol化学键的焓变称为键焓。已知H—H、H—O和O===O键的键焓ΔH分别为436 kJ·mol-1、463 kJ·mol-1和495 kJ·mol-1。下列热化学方程式正确的是
A. H2O(g)===H2+1/2O2(g)ΔH=-485 kJ·mol-1
B. H2O(g)===H2(g)+1/2O2(g) ΔH=+485 kJ·mol-1
C. 2H2(g)+O2(g)===2H2O(g) ΔH=+485 kJ·mol-1
D. 2H2(g)+O2(g)===2H2O(g) ΔH=-485 kJ·mol-1
难度: 简单查看答案及解析
-
下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)===CO2(g) ΔH1 C(s)+1/2O2(g)===CO(g) ΔH2
②S(s)+O2(g)===SO2(g) ΔH3 S(g)+O2(g)===SO2(g) ΔH4
③H2(g)+1/2O2(g)===H2O(l) ΔH5 2H2(g)+O2(g)===2H2O(l) ΔH6
④CaCO3(s)===CaO(s)+CO2(g) ΔH7 CaO(s)+H2O(l)===Ca(OH)2(s) ΔH8
A.① B.④ C.②③④ D.①②③
难度: 极难查看答案及解析
-
下列依据热化学方程式得出的结论正确的是( )
A. 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ·mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量
B. 已知2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ·mol--1,则氢气的燃烧热为241.8 kJ·mol-1
C. 已知2C(s)+2O2(g)=2CO2(g)△H=a、2C(s)+O2(g)=2CO(g)△H=b,则a>b
D. 已知P (白磷,s)=P (红磷,s)△H<0,则白磷比红磷稳定
难度: 中等查看答案及解析
-
对Na、Mg、Al的有关性质的叙述正确的是( )
A. 碱性:NaOH<Mg(OH)2<Al(OH)3 B. 第一电离能:Na<Mg<Al
C. 电负性:Na>Mg>Al D. 还原性:Na>Mg>Al
难度: 中等查看答案及解析
-
金属镍有广泛的用途.粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是
(已知:氧化性Fe2+<Ni2+<Cu2+)
A. 阳极发生还原反应,其电极反应式:Ni2++2e-===Ni
B. 电解过程中,阳极质量的减少与阴极质量的增加相等
C. 电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D. 电解后,电解槽底部的阳极泥中只有Cu和Pt
难度: 简单查看答案及解析
-
1 L某溶液中含有的离子如下表:
离子
Cu2+
Al3+
NO
Cl-
物质的量浓度(mol·L-1)
1
1
a
1
用惰性电极电解该溶液,当电路中有3 mol e-通过时(忽略电解时溶液体积的变化及电极产物可能存在的溶解现象),下列说法正确的是( )
A. 电解后溶液呈酸性 B. a=3
C. 阳极生成1.5 mol Cl2 D. 阴极析出的金属是铜与铝
难度: 中等查看答案及解析
-
如图是某同学设计的原电池装置,下列叙述中正确的是
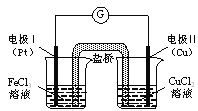
A. 电极Ⅰ上发生还原反应,作原电池的负极
B. 电极Ⅱ的电极反应式为: Cu2++2e-=" Cu"
C. 该原电池的总反应为: 2Fe3++Cu= Cu2++2Fe2+
D. 盐桥中装有含氯化钾的琼脂,其作用是传递电子
难度: 中等查看答案及解析
-
将等质量的两份锌粉a、b分别加入过量的稀硫酸,同时向a中加少量CuSO4溶液,下图中产生H2的体积V(L)与时间t(min)的关系,其中正确的是
A.
 B.
B.  C.
C.  D.
D. 
难度: 中等查看答案及解析
-
为保护地下钢管不受腐蚀,可采取的措施有( )
A. 与石墨棒相连 B. 与铜板相连
C. 埋在潮湿、疏松的土壤中 D. 与锌板相连
难度: 简单查看答案及解析
-
一定温度下,可逆反应H2(g)+I2(g)
2HI(g)达到化学平衡状态的标志是( )
A. 混合气体的压强不再变化
B. 混合气体的颜色不再变化
C. 反应速率v(H2)=1/2v(HI)
D. c(H2)∶c(I2)∶c(HI)=1∶1∶2
难度: 中等查看答案及解析
-
在密闭容器中进行反应:X2(g)+Y2(g)
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度可能是
A. Z为0.3 mol·L-1 B. Y2为0.4 mol·L-1
C. X2为0.2 mol·L-1 D. Z为0.4 mol·L-1
难度: 中等查看答案及解析
-
下列反应过程中,ΔH>0且ΔS>0的是
A. NH3(g)+HCl(g)
NH4Cl(s)
B. CaCO3(s)
CaO(s)+CO2(g)
C. 4Al(s)+3O2(g)
2Al2O3(s)
D. HCl(aq)+NaOH(aq)
NaCl(aq)+H2O(l)
难度: 中等查看答案及解析
-
在恒容密闭容器中通入A、B两种气体,在一定条件下发生反应:
2A(g)+B(g)
2C(g) ΔH>0。
达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是( )

选项
x
y
A
再通入A
B的转化率
B
加入催化剂
A的体积分数
C
压强
混合气体的总物质的量
D
温度
混合气体的总物质的量
难度: 中等查看答案及解析
-
在一密闭容器中,反应 aA(g)
bB(g)+cC(g)达平衡后,保持温度不变,将容器体积增加一倍,最终测得A的物质的量的浓度变为原来的50%,则
A. 平衡向正反应方向移动 B. a>(b+c)
C. 物质B的质量分数增大 D. 以上判断都错误
难度: 中等查看答案及解析
-
已知反应①CO(g)+CuO(s)
CO2(g)+Cu(s)和反应②H2(g)+CuO(s)
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A. 反应①的平衡常数K1=c(CO2).c(Cu)/c(CO).c(CuO)
B. 反应③的平衡常数K=K1/K2
C. 对于反应③,恒容时,温度升高,H2浓度减小,则该反应的焓变为正值
D. 对于反应③,恒温恒容下,增大压强,H2浓度一定减小
难度: 中等查看答案及解析
-
下列关于价电子排布式为3s23p4的粒子的描述正确的是( )
A. 它的原子核外有三种形状不同的电子云
B. 它的原子核外电子共有16种不同的运动状态
C. 它可与H2反应生成常温时的液态化合物
D. 该原子的轨道表示式为
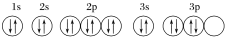
难度: 中等查看答案及解析
-
反应2SO2(g)+O2(g)
2SO3(g) ΔH<0已达平衡,其他条件不变时,分别改变下列条件,对化学反应速率和化学平衡会产生影响,下列条件与图像不相符的是

(O~t1:v正=v逆;t1时改变条件,t2时重新建立平衡)
A. 增大氧气的浓度 B. 增大压强 C. 升高温度 D. 加入催化剂
难度: 中等查看答案及解析
-
一定温度下,在某密闭容器中发生反应:2HI(g)
H2(g)+I2(s) ΔH>0,若0~15 s内c(HI)由0.1 mol·L-1降到0.07 mol·L-1,则下列说法正确的是 ( )
A. 0~15 s内用I2表示的平均反应速率为v(I2)=0.001 mol·L-1·s-1
B. c(HI)由0.07 mol·L-1降到0.05 mol·L-1所需的反应时间小于10 s
C. 升高温度正反应速率加快,逆反应速率减慢
D. 减小反应体系的体积,化学反应速率加快
难度: 中等查看答案及解析
-
T ℃时,在一固定容积的密闭容器中发生反应:A(g)+B(g)
C(s) ΔH<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是( )

A. T ℃时,该反应的平衡常数值为4
B. c点没有达到平衡,此时反应向逆向进行
C. 若c点为平衡点,则此时容器内的温度高于T ℃
D. T ℃时,直线cd上的点均为平衡状态
难度: 中等查看答案及解析
-
25 ℃时,水的电离达到平衡:H2O
H++OH- ΔH>0,下列叙述正确的是( )
A. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B. 向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C. 向水中加入少量盐酸,平衡逆向移动,c(OH-)增大
D. 将水加热,KW增大,pH不变,呈中性
难度: 中等查看答案及解析
-
生活中处处有化学,下列有关说法正确的是
A.天然弱碱性水呈碱性的原因是其中含有较多的Mg2+、Ca2+等离子
B.焊接时用NH4Cl溶液除锈与盐类水解无关
C.生活中用电解食盐水的方法制取消毒液,运用了盐类的水解原理
D.在滴有酚酞的Na2CO3溶液中慢慢滴入BaCl2溶液,溶液的红色逐渐褪去
难度: 中等查看答案及解析