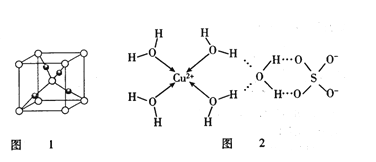
-
2017 年世界环境日主题为“人人参与创建绿色家园”,中国的主题是“绿水青山就是金山银山”。下列做法不应提倡的是
A. 推广煤改气集中供暖 B. 深埋处理旧电池
C. 乘公共交通工具出行 D. 推广太阳能热水器的使用
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是( )
A. 黄铁矿主要成分的化学式:FeS B. 一氧化碳分子的比例模型:

C. 氯离子的结构示意图:
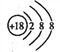 D. 氢氧化钡的电子式:
D. 氢氧化钡的电子式: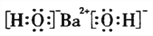
难度: 简单查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是
A. NH3易液化,可用作制冷剂
B. 晶体硅的硬度大,可用于制作光电板
C. FeCl3具有氧化性,可用于自来水的杀菌消毒
D. 溴化银具有感光性,可用于人工降雨
难度: 简单查看答案及解析
-
下列制取SO2、验证其漂白性、氧化性并进行尾气处理的装置和原理不能达到实验目的的是
A. 制取二氧化硫
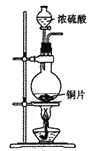 B. 验证漂白性
B. 验证漂白性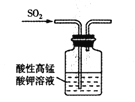 C. 验证氧化性
C. 验证氧化性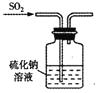 D. 尾气处理
D. 尾气处理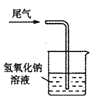
难度: 简单查看答案及解析
-
短周期主族元素A、B、C、D、E 的原子序数依次增大,其中A 与C同主族,A 与其它元素不在同一周期,B 与D同主族,B 为地壳中含量最多的元素。下列推断中正确的是
A. 元素B、C 简单离子半径的大小:r(B)<r(C)
B. 元素E 的氧化物对应的水化物均为强酸
C. 元素D、E 氢化物的热稳定性:E>D
D. 元素B 分别与A、C 形成化合物的晶体类型相同
难度: 简单查看答案及解析
-
下列指定反应的离子方程式正确的是
A. 镁条投入浓硫酸中:Mg+2H+ =Mg2++ H2↑
B. 用惰性电极电解氯化铝溶液:2Cl-+2H2O
H2↑+Cl2↑+2OH-
C. 向硫酸铁溶液中加入铜粉:Fe3++Cu=Fe2++Cu2+
D. 向偏铝酸钠溶液中通入足量二氧化碳:AlO2-+CO2+2H2O=Al(OH)3↓+ HCO3-
难度: 简单查看答案及解析
-
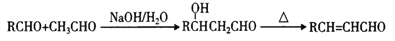
下列物质转化在给定条件下不能实现的是
A. Fe2O3
FeCl3(aq)
无水FeCl3
B. Al2O3
NaAlO2(aq)
AlCl3(aq)
C. NH3
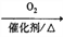 NO
NOHNO3
D. SiO2
H2SiO3
Na2SiO3
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是
A. 无色透明的溶液中:Cu2+、Mg2+、SO42-、Cl-
B. c(ClO-)=1mol·L-1的溶液中:K+、Al3+、I-、SO42-
C. 能使甲基橙变红的溶液中:Na+、NH4+、Cl-、NO3-
D. c(H+)/c(OH-)=1×1012的溶液中:K+、NH4+、HCO3-、NO3-
难度: 简单查看答案及解析
-
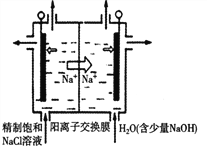
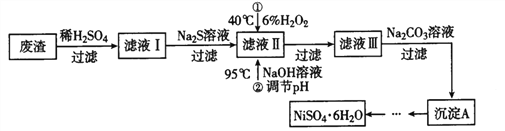
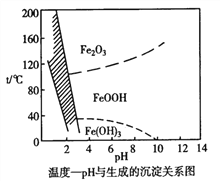
H2S 有剧毒,石油化工中常用以下方法处理石油炼制过程中产生的H2S废气。先将含H2S 的废气(其它成分不参与反应)通入FeCl3溶液中,过滤后将溶液加入到以铁和石墨棒为电极的电解槽中电解(如下图所示),电解后的溶液可以循环利用。下列有关说法不正确的是
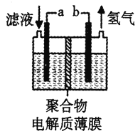
A. 过滤所得到沉淀的成分为S 和FeS
B. 与外接电源a极相连的电极反应为Fe2+-e-=Fe3+
C. 与外接电源b极相连的是铁电极
D. 若有0.20mol 的电子转移,得到氢气2.24L(标准状况)
难度: 中等查看答案及解析
-
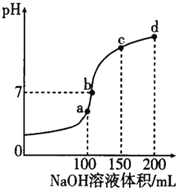
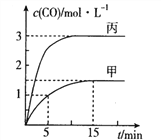
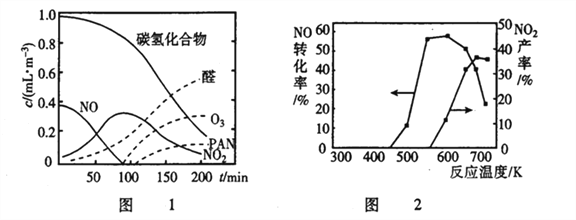
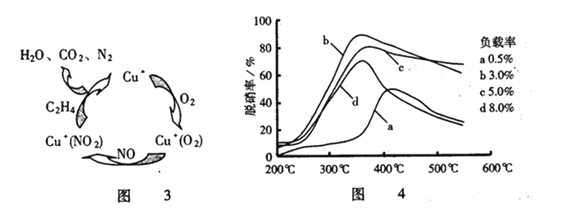
化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是
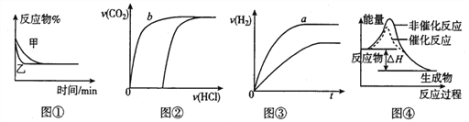
A. 图①表示不同压强对可逆反应2A(g)+2B(g)
3C(g) +D(s)的影响
B. 图②表示向10ml 0.1mol·L-1Na2CO3 和NaHCO3 两种溶液中分别滴加0.lnol·L-1HCl溶液时,CO2的体积随盐酸体积的变化,则b 表示的是NaHCO3 溶液
C. 图③表示体积和pH 均相同的HCl、CH3COOH 两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示的是HCl 溶液
D. 图④表示该反应为放热反应,且催化剂能改变反应的焓变
难度: 中等查看答案及解析
-
苯酚和丙酮都是重要的化工原料,工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下,下列有关说法正确的是

A. a.b 均属于芳香烃 B. a、d 中所有碳原子均处于同一平面上
C. a、c 均能与溴水反应 D. c、d均能发生氧化反应
难度: 简单查看答案及解析
-
根据下列实验操作和现象所得到的结论正确的是
选项
实验操作和现象
实验结论
A
向盛某盐溶液的试管中滴入氢氧化钠溶液后,试管口处湿润的红色石蕊试纸未变蓝
该盐中不含NH4+
B
将氧化铁加入到足量的HI溶液中,充分溶解后,滴加四氯化碳,振荡静置,下层呈紫红色
Fe3+氧化性强于I2
C
向蛋白质溶液中加入硫酸钠溶液,有沉淀出现
蛋白质发生变性
D
某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成
溶液中一定含SO42-或Ag-
A. A B. B C. C D. D
难度: 简单查看答案及解析