-
下列说法正确的是 ( )
A. 在常温下,放热反应一般能自发进行,吸热反应都不能自发进行
B. NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g) △H=+185.57 kJ·mol-1,能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
C. 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
D. 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向
难度: 简单查看答案及解析
-
某混合溶液中所含离子的浓度如下表,则Mn+及a值可能为

A. Mg2+、1 B. Ba2+、0.5 C. Al3+、1.5 D. Fe2+、2
难度: 中等查看答案及解析
-
下列推断正确的是
A. pH=6.5的溶液一定显酸性
B. 0.1mol•L-1的Na2CO3溶液中:c(CO32-)+c(HCO3-)=0.1mol•L-1
C. 常温下,等体积的0.2 mol•L-1的盐酸与0.2 mol•L-1的氢氧化钡溶液混合,所得溶液的pH=13
D. 常温下某溶液中水电离出的c(OH-)=l×10-12mol•L-1,该溶液pH 一定等于2
难度: 简单查看答案及解析
-
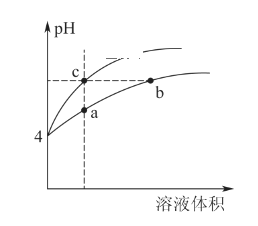
对室温下c(H+)相同、体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是
A. 加适量的醋酸钠晶体后,两溶液的c(H+)均减小
B. 使温度都升高20℃后,两溶液的c(H+)均不变
C. 加水稀释2倍后,两溶液的c(H+)均增大
D. 加足量的锌充分反应后,两溶液中产生的氢气一样多
难度: 中等查看答案及解析
-
某弱酸溶液中存在电离平衡HA
H++A-,下列叙述不正确的是
A. 溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(A-)
B. 0.10 mol/L的HA溶液中加水稀释,溶液中c(OH-)增大
C. HA溶液中加少量的NaA固体,平衡逆向移动
D. 常温下,加入NaA固体可使HA的电离常数变小
难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列叙述正确的是
A. 71 g氯气被还原得到的电子数为2NA
B. 100 mL l mol·L-1的碳酸钠溶液中含有的CO32-数为0.1NA
C. 标准状况下,2.24 L苯中含有的碳原子数为0.6NA
D. 用含有少量锌、铁、银等杂质的粗铜作阳极电解精炼,当阴极析出64 g金属时阳极失去的电子数小于2NA
难度: 中等查看答案及解析
-
下列事实不能用勒夏特列原理解释的是
A. 光照新制的氯水时,溶液的c(H+)逐渐增大
B. 对CO(g)+NO2(g)
CO2(g)+NO(g),平衡体系增大压强可使颜色变深
C. 升高温度能够促进水的电离
D. 在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
难度: 中等查看答案及解析
-
下列有关说法正确的是
A. 常温下,0.1 mol/L Na2S溶液中存在:c(OH-) =c(H+) +c(HS-) +c(H2S)
B. 常温下,pH为1的0.1 mol/L HA溶液与0.1 mol/L NaOH溶液恰好完全反应时,溶液中一定存在:c(Na+) =c(A-)>c(OH-) =c(H+)
C. 常温下,pH=7的CH3COONa和CH3COOH混合溶液中c(Na+)=0.1 mol/L:c(Na+) =c(CH3COOH)>c(CH3COO-)>c(H+) =c(OH-)
D. 常温下,将0.1 mol/L CH3COOH溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中
的值减小到原来的1/10
难度: 困难查看答案及解析
-
化学平衡常数(K)、电离常数(Ka,Kb)、溶度积常数(Ksp)等常数是表示判断物质性质的重要常数。下列关于这些常数的说法不正确的是
A. 化学平衡常数的大小只与温度有关,与浓度、压强、催化剂无关
B. 相同温度时,Ka(HCN)<Ka(CH3COOH),说明物质的量浓度相同时,氢氰 酸的酸性比醋酸弱
C. 向氯化钡溶液中加入同浓度的碳酸钠和硫酸钠溶液,先产生BaSO4沉淀,则Ksp( BaSO4)>Ksp(BaCO3)
D. 当温度升高时,Ka(CH3COOH)变大
难度: 中等查看答案及解析
-
已知:25 °C时,某些弱酸的电离常数如下表,下列说法正确的是
H2SO3
H2CO3
CH3COOH
HClO
Kl=1.54×10-2
K1==4.30×10-7
K=1.8×l0-5
K = 2. 95×l0-8
K2=1.02×10-7
K2=5.61×l0-11
A. 向漂白粉溶液中加入少量NaHSO3可增强漂白性
B. 向Na2CO3溶液中通入少量SO2发生反应的离子方程式为:2CO32-+SO2+H2O=2HCO3-+SO32-
C. 相同浓度的NaClO、Na2CO3、NaHCO3溶液的pH值由大到小的顺序为:NaClO>Na2CO3>NaHCO3
D. 相同浓度的CH3COONa和NaClO溶液混合后,溶液中各离子浓度的大小关系为:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
难度: 困难查看答案及解析
-
如图所示能够组成原电池,并且产生明显的电流的是( )
A.
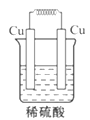 B.
B. 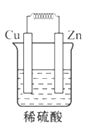 C.
C.  D.
D. 
难度: 中等查看答案及解析
-
白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P akJ·mol—1、P—O bkJ·mol—1、P="O" ckJ·mol—1、O="O " dkJ·mol—1。
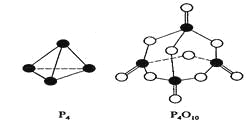
根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )
A. (6a+5d-4c-12b)kJ·mol—1B(4c+12b-6a-5d)kJ·mol—1 B. (4c+12b-4a-5d)kJ·mol—1
C. (4a+5d-4c-12b)kJ·mol—1
难度: 中等查看答案及解析
-
25 ℃时,下列溶液中微粒存在情况不合理的是
①Fe2+、Mg2+、OH-、Cl-能大量共存
②含Br-、Ba2+、Na+、HC
的溶液,通入CO2后这些离子仍能大量共存
③向含K+、Na+、N
、Cl-的溶液中滴加少量溴水,离子能大量共存
④硝酸钠和氯化钡混合溶液中,离子的浓度为c(Ba2+)=0.2 mol/L,c(Na+)=0.2 mol/L,c(N
)=0.3 mol/L,c(Cl-)=0.1 mol/L
A. ①③
B. ②③
C. ①④
D. ②④
难度: 中等查看答案及解析
-
如图所示是氢氧燃料电池的基本结构,将电极a、b分别与负载连接后,电池就能正常工作。下列有关该燃料电池工作时的叙述不正确的是
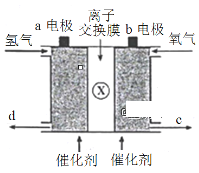
A. a电极一定是负极
B. 若X是H+,则H+将从a电极通过离子交换膜移向b电极
C. 若X是O2-,则生成的水将从d口流出
D. 溶液中的电流方向是从b流向a
难度: 中等查看答案及解析
-
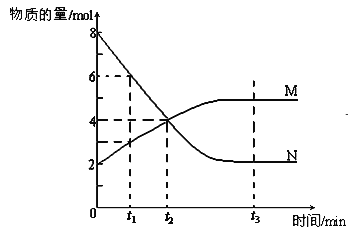
在一定温度时,将1 mol A和2 mol B放入容积为5 L的某密闭容器中发生反应A(s)+2B(g)
C(g)+2D(g),经5 min后,测得容器内B的浓度减少了0.2 mol/L。下列叙述中错误的是
A. 在5 min内该反应用C的浓度变化表示的反应速率为0.02 mol/(L•min)
B. 5 min时,容器内D的浓度为0.2 mol/L
C. 该可逆反应随着反应的进行,容器内压强逐渐增大
D. 5 min时,容器内气体总的物质的量为3 mol
难度: 中等查看答案及解析
-
用石墨电极电解100mL H2SO4与CuSO4的混合液,通电一段时间后,两极均收集到2.24L(标况)气体,则原混合液中Cu2+的物质的量浓度为
A.0.5mol/L B.1mol/L C.2mol/L D.4mol/L
难度: 困难查看答案及解析
-
铅蓄电池的两极分别为Pb、PbO2,电解质溶液为硫酸,工作时反应为:Pb+PbO2+2H2SO4
2PbSO4+2H2O,下列结论正确的是
A. Pb为正极被氧化
B. SO42-只向PbO2极移动
C. 电解质溶液密度不断减小
D. 溶液的pH不断减小
难度: 中等查看答案及解析
-
已知有反应:2A(g)+B(g)
3C(g) △H<0,在恒容的密闭容器中,通入A和B气体,反应达到平衡后,若仅改变图中x的值,则y随x变化趋势合理的是
选项
x
y
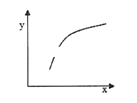
A
温度
容器内混合气体的密度
B
A的物质的量
B的转化率
C
催化剂的质量
C的体积分数
D
充入稀有气体
逆反应速率
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
已知同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2。就溶解或电离出S2-的能力而言,FeS>H2S>CuS,则下列离子方程式错误的是
A. Mg2++2HCO3-+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O
B. Cu2++H2S=CuS↓+2H+
C. Zn2++S2-+2H2O=Zn(OH)2↓+H2S↑
D. FeS+2H+=Fe2++H2S↑
难度: 简单查看答案及解析
-
硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下,下列说法正确的是
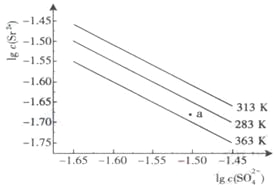
A. 温度一定时,Ksp(SrSO4)随c(SO42-)的增大而减小
B. 三个不同温度中,363K时Ksp(SrSO4)最大
C. 283K时,图中a点对应的溶液是不饱和溶液
D. 283K下的SrSO4饱和溶液升温到363K后变为不饱和溶液
难度: 困难查看答案及解析
-
常温下Ag2SO4、AgCl、AgI的溶度积常数依次为:Ksp(Ag2SO4)=7.7×10-5、Ksp(AgCl)=1.8×10-10、Ksp(AgI)=8.3×10-17。下列有关说法中,错误的是
A. 常温下,Ag2SO4、AgCl、AgI在水中的溶解能力依次减弱
B. 在AgCl饱和溶液中加入NaI固体,有AgI沉淀生成
C. Ag2SO4、AgCl、AgI的溶度积常数之比等于它们饱和溶液的物质的量浓度之比
D. 在Ag2SO4饱和溶液中加入Na2SO4固体有Ag2SO4沉淀析出
难度: 中等查看答案及解析
-
下列说法正确的是
A. 用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可加快产生氢气的速率
B. 对于反应2H2O2=2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率
C. 将铜片放入稀硫酸中,无明显现象;若再向所得溶液中加入硝酸银溶液,一段时间后,由于形成原电池,可看到有氢气产生
D. 100mL 2mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
难度: 简单查看答案及解析
-
在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)
2SO3(g) ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是


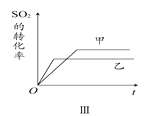
A. 图Ⅰ研究的是t0时刻增大O2的物质的量浓度对反应速率的影响
B. 图Ⅱ研究的是t0时刻通入氦气增大体系压强对反应速率的影响
C. 图Ⅲ研究的是催化剂对化学平衡的影响,且甲的催化效率比乙高
D. 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
难度: 中等查看答案及解析