-
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率但不影响生成H2的总量,可向盐酸中加入适量的
A. CaCO3(s) B. Na2SO4溶液
C. KNO3溶液 D. CuSO4(s)
难度: 简单查看答案及解析
-
已知H—H键能为436 kJ·mol-1,H—N键能为391 kJ·mol-1,根据化学方程式:N2 + 3H2 = 2NH3 ΔH = -92.4 kJ·mol-1,则N≡N键的键能是( )
A. 431 kJ·mol-1 B. 946 kJ·mol-1
C. 649 kJ·mol-1 D. 869 kJ·mol-1
难度: 中等查看答案及解析
-
下列措施对增大反应速率明显有效的是( )
A. Al在氧气中燃烧生成A12O3,将Al片改成Al粉
B. Fe与稀硫酸反应制取H2时,改用浓硫酸
C. 在K2SO4与BaCl2两溶液反应时,增大压强
D. Na与水反应时增大水的用量
难度: 中等查看答案及解析
-
“低碳经济,节能减排”是21世纪世界经济发展的新思路,下列与之相悖的是( )
A. 开发水能、风能、太阳能、地热能、核能等新能源,减少使用煤、石油等化石燃料
B. 大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
C. 大力发展新能源汽车,如混合动力汽车、电动汽车等,以减少碳、氮氧化物的排放
D. 大力开采煤、石油和天然气,以满足经济发展的需要
难度: 简单查看答案及解析
-
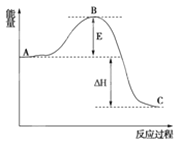
下列反应过程中的能量变化情况符合右图的是( )
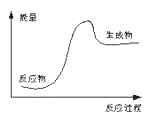
A. 酸与碱的中和反应 B. 石灰石高温分解反应 C. 镁和盐酸的反应 D. 氧化钙和水反应
难度: 简单查看答案及解析
-
分别取40mL的0.50mol/L盐酸与40mL0.55mol/L氢氧化钠溶液进行中和热的测定.下列说法错误的是( )
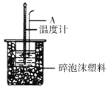
A.稍过量的氢氧化钠是确保盐酸完全反应
B.仪器A的名称是环形玻璃搅拌棒
C.在实验过程中,把温度计上的酸用水冲洗干净后再测量NaOH溶液的温度
D.用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,结果也是正确的
难度: 中等查看答案及解析
-
在C(s)+CO2(g)
2CO(g)反应中可使化学反应速率增大的措施是
①增大压强 ②增加碳的量 ③恒容通入CO2④恒压充入N2⑤恒容充入N2
A. ①⑤ B. ②④ C. ①③ D. ③⑤
难度: 简单查看答案及解析
-
沼气是一种能源,它的主要成分是CH4,0.5molCH4完全燃烧生成CO2和液态水时放出445kJ的热量,则下列热化学方程式中正确的是
A. 2CH4(g)+4O2(g)=2CO2(g)+4H2O(g)△H=+890kJ•mol﹣1
B. CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=+890kJ•mol﹣1
C. 1/2 CH4(g)+O2(g)=CO2(g)+H2O(l)△H=﹣890kJ•mol﹣1
D. CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣890kJ•mol﹣1
难度: 困难查看答案及解析
-
关于下列装置说法正确的是

A. 装置①中,盐桥中的K+移向ZnSO4溶液
B. 滴有酚酞溶液的装置②在电解过程中,b极先变红
C. 可以用装置③在铁上镀铜,d极为铜
D. 装置④中发生铁的吸氧腐蚀
难度: 中等查看答案及解析
-
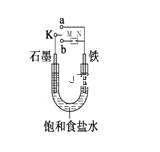
某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
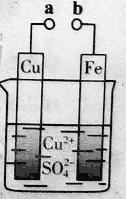
A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu
C. 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D. a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
难度: 中等查看答案及解析
-
现有反应2SO3(g)
2SO2(g)+O2(g) △H>0 ,下列有关说法正确的是
A. △H>0的化学反应一定不能自发进行 B. 该反应熵增大(即△S>0)
C. 该反应在任何条件下一定能自发 D. 自发过程一定使体系的熵增大
难度: 简单查看答案及解析
-
A、B、C是三种金属,根据下列①、②两个实验:①将A与B浸在稀硫酸中用导线相连,A上有气泡逸出,B逐渐溶解;②电解物质的量浓度相同的A、C盐溶液时,阴极上先析出C(使用惰性电极)。确定它们的还原性强弱顺序为 ( )
A. A>B>C B. B>C>A C. C>A>B D. B>A>C
难度: 中等查看答案及解析
-
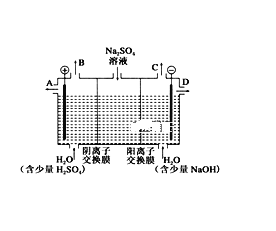
关于下图所示①、②两个装置的叙述中,正确的是( )
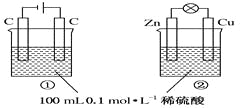
A. 硫酸浓度变化:①增大,②减小
B. 装置名称:①是原电池,②是电解池
C. 电极反应式:①中阳极:4OH--4e-=2H2O+O2↑;②中正极:Zn-2e-===Zn2+
D. 离子移动方向:①中H+向阴极方向移动,②中H+向负极方向移动
难度: 中等查看答案及解析
-
COCl2(g)
CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,其中能提高COCl2转化率的是
A. ①②④ B. ①④⑥ C. ②③⑤ D. ③⑤⑥
难度: 中等查看答案及解析
-
可逆反应2A(g)+3B(g)
4C(g)+D(g), 已知起始浓度c(A)=4 mol·L-1,c(B)=3 mol·L-1,C、D浓度均等于0,反应开始2 秒后达到平衡状态,此时D 的平衡浓度为0.5 mol·L-1,则下列说法不正确的是( )
A. 反应速率v(C)= 1mol/(L·s) B. C的平衡浓度为4mol /L
C. A的转化率为25% D. B的平衡浓度为1.5mol /L
难度: 中等查看答案及解析
-
25 ℃时,水的电离达到平衡:H2O
H++ OH-;ΔH > 0 ,下列叙述正确的是
A. 向水中加人稀氨水,平衡逆向移动,c(OH-)降低
B. 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C. 向水中加人少量固体CH3COONa ,平衡逆向移动,c(H+)降低
D. 将水加热,Kw增大,pH不变
难度: 中等查看答案及解析
-
在密闭容器中发生下列反应aA(g)
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
A. A的转化率变小 B. 平衡向正反应方向移动
C. D的体积分数变大 D. a > c+d
难度: 中等查看答案及解析
-
在25℃时,用蒸馏水稀释1mol/L的醋酸溶液至0.01mol/L,随溶液的稀释,下列各项中始终保持增大趋势的是( )
A. c(H+)/c(CH3COOH) B. c(CH3COOH)/c(H+)
C. n(CH3COOH)/c(CH3COO-) D. c(CH3COO-) c(H+)/c(CH3COOH)
难度: 中等查看答案及解析
-
某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应3A(g)+2B(g)
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是( )
A. 该反应的化学平衡常数表达式是
B. 此时,B的平衡转化率是40%
C. 增大该体系的压强,化学平衡常数增大
D. 增加B,B的平衡转化率增大
难度: 中等查看答案及解析
-
下图是可逆反应A+2B
2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断
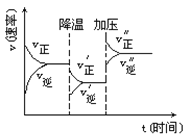
A.降温后逆反应速率增大
B.逆反应是放热反应
C.若A、B是气体,则D是液体或固体
D.A、B、C、D均为气体
难度: 中等查看答案及解析
-
一定温度下,在冰醋酸加水稀释的过程中,溶液的导电能力(I)随着加入水的体积V变化的曲线如图所示。下列说法正确的是( )
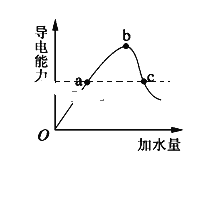
A. a、c两点pH不同
B. 向c溶液中加水,溶液中所有离子浓度都减小
C. 误用湿润的pH试纸测b点pH结果偏小
D. c(CH3COO-) /c(CH3COOH) b点大于c点
难度: 中等查看答案及解析
-
在0.1 mol/LCH3COOH溶液中存在如下电离平衡:CH3COOH
CH3COO-+H+,对于该平衡下列叙述正确的是
A. 加入水时,平衡逆向移动
B. 加入少量NaOH固体,平衡正向移动
C. 加入少量0.1 mol/L 盐酸,溶液中c(H+)减小
D. 加入少量CH3COONa固体,平衡正向移动
难度: 中等查看答案及解析
-
对于密闭容器中的可逆反应:mX (g) +nY(s)
pZ (g);ΔH<0,达化学平衡后,改变条件,下列表述不正确的是
A. 增大压强,化学平衡不一定发生移动
B. 通入氦气,化学平衡不一定发生移动
C. 增加X或Y的物质的量,化学平衡一定发生移动
D. 其它条件不变,升高温度,化学平衡一定发生移动
难度: 中等查看答案及解析
-
化学在生产和日常生活中有着重要的应用。下列说法不正确的是
A. 工业上电解熔融Al2O3制备金属铝
B. 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
C. 金属锌与稀硫酸反应制取氢气,粗锌比纯锌反应速率快
D. 电解MgCl2饱和溶液,可制得金属镁
难度: 中等查看答案及解析