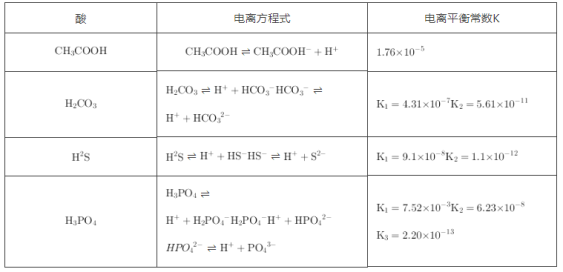
-
室温时,柠檬水溶液的pH是3,其中的c(OH-)是
A. 0.1 mol/L B. 1×10-3 mol/L C. 1×10-7 mol/L D. 1×10-11 mol/L
难度: 中等查看答案及解析
-
下列仪器中,没有“0”刻度线的是 ( )
A. 量筒 B. 温度计 C. 酸式滴定管 D. 托盘天平游码刻度尺
难度: 简单查看答案及解析
-
下列叙述不正确的是 ( )
A. 将CuCl2 溶液加热蒸干,并灼烧,最终得到CuO
B. 将FeCl2 溶液加热蒸干,并灼烧,最终得到FeO
C. 实验室里盛放碳酸钠溶液的试剂瓶必须用橡胶塞而不用玻璃塞
D. 厨房中可以用碳酸钠溶液洗涤餐具上的油污
难度: 中等查看答案及解析
-
等物质的量浓度的下列稀溶液:①乙酸 ②碳酸③盐酸④硫酸,它们的pH由小到大排列正确的是( )
A. ①②③④ B. ④③①② C. ④②③① D. ④②①③
难度: 中等查看答案及解析
-
常温下,某溶液中由水电离出来的C(H +)=1.0×10-11mol/L,该溶液可能是①硫酸钠溶液②氢氧化钠溶液 ③二氧化碳水溶液④硝酸铵水溶液 ( )
A. ①④ B. ①② C. ②③ D. ③④
难度: 中等查看答案及解析
-
同温度同浓度的下列溶液中CNH4+最大的是 ( )
A. NH4HSO4 B. NH4NO3 C. NH4Ac D. NH3• H2O
难度: 中等查看答案及解析
-
在一定温度不同压强(P1<P2)下,可逆反应2X(g)
2Y(g) + Z(g)中,生成物
Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是

难度: 中等查看答案及解析
-
在室温下等体积的酸和碱的溶液,混合后pH 一定大于7的是 ( )
A. pH =3的硝酸跟pH =11的Ba(OH)2溶液
B. pH =3的盐酸跟pH =11的氨水溶液
C. pH =3的硫酸跟pH =11的KOH 溶液
D. pH =3的醋酸跟pH =11的Ba(OH)2溶液
难度: 困难查看答案及解析
-
0.1mol/L CH3COONa 溶液中各种阴阳离子浓度的大小关系正确是 ( )
A. c(H+)>c(OH-)>c(CH3COO-)>c(Na+) B. c(H+)> c(Na+)>c(CH3COO-)>c(OH-)
C. c(Na+)>c(CH3COO-)>c(OH-)>c(H+) D. c(OH-)> c(Na+)>c(CH3COO-)>c(H+)
难度: 中等查看答案及解析
-
下列有关滴定的操作正确的顺序是①标准液润洗滴定管②往滴定管中注入标准溶液③检查滴定管是否漏水 ④滴定 ⑤洗涤 ( )
A. ⑤①③②④ B. ③⑤①②④ C. ⑤②③①④ D. ②①③⑤④
难度: 简单查看答案及解析
-
一定量的盐酸与过量的铁粉反应时,为了减缓反应速率且不影响生成氢气的总量,可向盐酸中加入适量的:①NaOH固体;②Na2SO4溶液;③KNO3溶液;④H2O;⑤CH3COONa固体;⑥NH4Cl固体;⑦CuSO4固体 ⑧CaCO3固体
A.①②⑤⑦ B.②③⑥ C.②③④⑤ D.②④⑤
难度: 中等查看答案及解析
-
把pH=3的H2SO4和pH=10的NaOH溶液混合,如果混合液的pH=7,则H2SO4 和NaOH溶液的体积比是 ( )
A. 1:1 B. 1:10 C. 1:2 D. 1:20
难度: 中等查看答案及解析
-
用0.1mol/L NaOH溶液滴定0.lmol/L盐酸,如达到滴定的终点时不慎多加了1滴NaOH溶液(1滴溶液的体积约为0.05mL).继续加水至50mL,所得溶液的pH是
A. 4 B. 7.2 C. 10 D. 11.3
难度: 简单查看答案及解析
-
常温下,用0.1000mol/L的NaOH溶液滴定20ml同浓度的一元弱酸HA,滴定过程溶液pH随X的变化曲线如图所示(忽略中和热效应),下列说法不正确的是
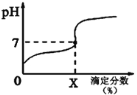
A. HA溶液加水稀释后,溶液中c(HA)/c(A-)的值减小
B. HA的电离常数KHA=10-7x/(100-x)(x为滴定分数)
C. 当滴定分数为100时,溶液中水的电离程度最大
D. 滴定分数大于100时,溶液中离子浓度关系是c(Na+)>c(A-)>c(OH-)>c(H+)
难度: 困难查看答案及解析