-
浓度为0.1 mol·L-1的HCl溶液VmL,加水稀释到2VmL,取出10 mL,这10 mL溶液中含有c(H+)( )
A. 0.5 mol·L-1 B. 0.01 mol·L-1 C. 0.02 mol·L-1 D. 0.05 mol·L-1
难度: 简单查看答案及解析
-
现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③碘的水溶液,分离以上各混合液的正确方法依次是 ( )
A. 分液、萃取、蒸馏 B. 分液、蒸馏、萃取
C. 萃取、蒸馏、分液 D. 蒸馏、萃取、分液
难度: 中等查看答案及解析
-
将5 mol·L-1的盐酸10 mL稀释到200mL,再取出5 mL,这5 mL溶液的物质的量浓度是( )
A. 0.05 mol·L-1 B. 0.25 mol·L-1 C. 0.1 mol·L-1 D. 0.5 mol·L-1
难度: 简单查看答案及解析
-
标况下,H2O的质量为xg,含有y个氢原子,则阿伏加德罗常数为( )
A. 18y/x B. 9y/x C. 18y/xmol﹣1 D. 9y/xmol﹣1
难度: 中等查看答案及解析
-
0.1 mol铁粉与含0.1 mol硫酸铁的溶液混合后充分后应,下列叙述正确的是( )
A. 氧化产物为0.1 mol B. 还原产物为0.1 mol
C. 氧化产物和还原产物共0.2 mol D. 氧化产物为0.2 mol
难度: 简单查看答案及解析
-
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O===2NO+HNO3+9HF。下列有关该反应的说法正确的是
A. NF3是氧化剂,H2O是还原剂
B. 若1 mol NF3被还原,反应转移电子数为2NA
C. 若生成0.4 mol HNO3,则转移0.4 mol电子
D. 氧化剂与还原剂的物质的量之比为2:1
难度: 简单查看答案及解析
-
下列关于金属性质的叙述中正确的是 ( )
A. 钠与氧气反应时,产物是由氧气的用量决定的
B. 铝箔在空气中受热可以熔化且会发生剧烈燃烧
C. 金属与非金属单质反应时,一定是金属被氧化
D. 铁丝不论在空气中还是纯氧中都不会燃烧
难度: 简单查看答案及解析
-
氧化铝用来制造耐火坩埚、耐火管和耐高温的实验仪器,是利用了氧化铝
A. 不溶于水 B. 熔点很高
C. 是金属氧化物 D. 高温下很难反应
难度: 简单查看答案及解析
-
有下列物质:①干燥的氯气、②过氧化钠、③次氯酸钠、④活性炭、⑤二氧化硫,其中能使品红溶液褪色的是( )
A. 除①外其他都可以 B. ①②③
C. ①④⑤ D. 全部
难度: 中等查看答案及解析
-
下面关于摩尔质量的描述或应用中正确的是
A. 一个钠原子的质量等于
g B. 二氧化碳的摩尔质量是44 g
C. 铁原子的摩尔质量等于它的相对原子质量 D. 1 mol氢氧根离子的质量是17
难度: 中等查看答案及解析
-
在下列操作中,一般情况下不能相互接触的是( )
A. 用胶头滴管向试管内滴加液体时,胶头滴管尖端与试管内壁
B. 分液时,分液漏斗下端与烧杯内壁
C. 过滤时,烧杯内壁与漏斗下端
D. 过滤时,玻璃棒与三层滤纸
难度: 中等查看答案及解析
-
下列关于过滤和蒸发的说法中正确的是( )
A. 过滤常用来分离液体与固体混合物
B. 若使溶液中的溶质析出只能选用加热蒸发的方法
C. 过滤和蒸发过程中都要用到玻璃棒,其作用相同
D. 洗涤过滤后固体的操作是向过滤器中加入洗涤剂,使洗涤剂浸没固体,待洗涤剂自然流下
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A. 摩尔是表示物质质量的单位
B. 物质的量就是指物质的质量
C. 摩尔是表示物质粒子多少的物理量
D. 物质的量适用于计量分子、原子、离子等粒子
难度: 简单查看答案及解析
-
某学生的实验报告所列出的下列数据中合理的是( )
A. 用10 mL量筒量取7.13 mL稀盐酸
B. 用20 mL量筒量取13.2 mL稀盐酸
C. 用广泛pH试纸测得某溶液的pH为2.3
D. 用天平称取物品的质量为5.872 g
难度: 简单查看答案及解析
-
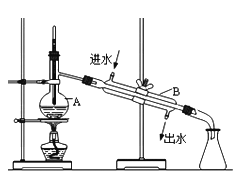
用如图所示装置进行如下实验,能达到实验目的是

A. 瓶中盛满水,从A口进气,用排水法收集氢气
B. 瓶中盛适量浓硫酸,从A口进气来干燥氨气
C. 从B口进气,用排空气法收集二氧化碳
D. 瓶中装满水,A口连导管并伸入量筒中,从B口进气,用排水法测量生成H2的体积
难度: 中等查看答案及解析
-
下列有关电解质的说法中正确的是( )
A. 固体氯化镁不导电,所以氯化镁不是电解质
B. 三氧化硫水溶液的导电性很好,所以三氧化硫是电解质
C. 熔融的铁导电性很好,所以铁是电解质
D. 氯化钾熔融状态能导电,所以氯化钾是电解质
难度: 中等查看答案及解析
-
下列碳原子的物质的量为1 mol的是( )
A. 0.012 kg C B. 0.012 kg12C
C. 0.012 kg13C D. 0.012 kg12C和13C
难度: 简单查看答案及解析
-
下列两种气体的分子数一定相等的是( )
A. 质量相等的O2和O3 B. 原子数目相等的CO和N2
C. 电子数目相等的O2和N2 D. 等压、等体积的N2和CH4
难度: 中等查看答案及解析
-
关于铜的性质的下列说法中不正确的是( )
A. 是一种紫红色的固体
B. 具有良好的延展性、导热性和导电性
C. 能与氯化铁溶液反应
D. 化学性质不活泼,不能与氧气反应
难度: 中等查看答案及解析
-
某无色溶液放入铝片后有氢气产生,下列离子在该溶液中一定能大量存在的是( )
A. Na+ B. Mg2+ C. H+ D.
难度: 中等查看答案及解析
-
下列有关氨的叙述中不正确的是( )
A. 氨分子中氮元素的化合价只能升高,氨具有还原性
B. 氨的催化氧化反应的化学方程式是4NH3+5O2
4NO+6H2O
C. 氨的催化氧化反应中若氧气过量则有红棕色气体生成
D. 氨的催化氧化属于人工氮的固定
难度: 中等查看答案及解析
-
已知气体的摩尔质量越小,扩散速度越快。右图所示为气体扩散速度的实验,两种气体扩散相遇时形成白色烟环。下列关于甲、乙的判断正确的是( )
A.甲是浓氨水,乙是浓硫酸 B.甲是浓盐酸,乙是浓氨水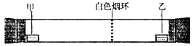
C.甲是浓氨水,乙是浓盐酸 D.甲是浓硝酸,乙是浓氨水
难度: 中等查看答案及解析
-
氧化铝是铝土矿的主要成分,氧化铝属于( )
A. 碱性氧化物 B. 酸性氧化物
C. 两性氧化物 D. 混合物
难度: 简单查看答案及解析
-
2.3 g纯净的金属钠在干燥的空气中,被氧化后得到3.5 g固体,由此可判断出产物是( )
A. 氧化钠 B. 过氧化钠
C. 氧化钠和过氧化钠的混合物 D. 无法确定
难度: 中等查看答案及解析
-
一定物质的量的CO2 与NaOH 溶液反应,所得溶液中含Na2CO3和NaHCO3,若两者物质的量之比为3∶5,则参加反应的CO2 与NaOH 的物质的量之比为( )
A. 3∶5 B. 1∶2 C. 18∶8 D. 8∶11
难度: 中等查看答案及解析
-
有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3物质的量浓度分别是4mol/L和2mol/L,取10mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下的气体为( )
A. 2.24L B. 1.12L C. 0.672L D. 0.448L
难度: 中等查看答案及解析
-
除去氧化铁中的二氧化硅,可采用的试剂是
A. 盐酸 B. 硝酸 C. 蒸馏水 D. 烧碱溶液
难度: 简单查看答案及解析
-
在标准状况下,三个干燥的烧瓶内分别装入:干燥纯净的氨气、含有部分空气的氯化氢气体、体积比为4∶10的二氧化氮与氧气的混合气体。分别做喷泉实验,最终三个烧瓶中所得溶液的物质的量浓度(假设溶液不外渗)之比为( )
A. 2∶1∶2 B. 5∶5∶4 C. 1∶1∶1 D. 无法确定
难度: 中等查看答案及解析