-
在配制一定物质的量浓度的NaOH溶液时,会造成所配溶液浓度偏高的是
A. 所用NaOH已经潮解 B. 向容量瓶中加水未到刻度线
C. 有少量NaOH溶液残留在烧杯里 D. 称量时误用“左码右物”
难度: 中等查看答案及解析
-
下列有关四种基本反应类型与氧化还原反应关系的说法中正确的是
A. 置换反应一定是氧化还原反应 B. 分解反应一定不是氧化还原反应
C. 化合反应一定是氧化还原反应 D. 复分解反应不一定是氧化还原反应
难度: 中等查看答案及解析
-
下图所示是分离混合物时常用的仪器,从左至右,可以进行的混合物分离操作分别是
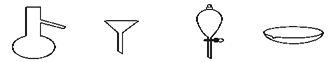
A. 蒸馏、蒸发、萃取、过滤 B. 蒸馏、过滤、萃取、蒸发
C. 萃取、过滤、蒸馏、蒸发 D. 过滤、蒸发、萃取、蒸馏
难度: 简单查看答案及解析
-
下列事实与胶体知识有关的是
①晨雾中看见叶缝透过光束的通路 ②一支钢笔使用不同牌号的蓝黑墨水易出现堵
塞 ③静电除尘 ④豆浆做豆花 ⑤血液透析 ⑥在江河入海口处容易形成沙洲
A. ①②⑤⑥ B. ①④⑤⑥ C. ①③⑤⑥ D. 全部都有关
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数,下列叙述中正确的是。
A. 常温常压下,11.2L氧气所含的原子数为NA
B. 标准状况下,1.12L氦气所含的原子数为0.1NA
C. 7.8 g Na2O2离子中含有的阴离子数为0.1NA
D. 15.6 g Na2O2与过量CO2反应时,转移的电子数为0.4NA
难度: 中等查看答案及解析
-
下列各组中的两物质相互反应时,其生成物与反应条件和反应物用量无关的是
A. Na和O2 B. Na和H2O C. CO2和NaOH D. C和O2
难度: 中等查看答案及解析
-
黑火药发生爆炸的反应:2KNO3 + S+ 3C = K2S +N2 ↑+ 3CO2↑,被还原的元素是 ( )
A.氮 B.碳 C.氮和碳 D.氮和硫
难度: 中等查看答案及解析
-
吸入人体内的氧有2%转化为氧化性极强的“活性氧”,它能加速人体衰老,被称为“生命杀手”,服用含硒元素(Se)的化合物亚硒酸钠(Na2SeO3),能消除人体内的活性氧,由此推断Na2SeO3的作用是
A. 作还原剂 B. 作氧化剂
C. 既作氧化剂又作还原剂 D. 既不作氧化剂又不作还原剂
难度: 简单查看答案及解析
-
已知下列三个反应可以进行:2W-+X2=2X- + W2;2Y-+W2=2W-+Y2;2X-+Z2=2Z-+X2。下列结论正确的是
A. 还原性:X- > Y- B. 在X-、Y-、Z-、W- 中 Z- 的还原性最强
C. 氧化性:Z2 > W2 D. 反应2Z- + Y2 = 2Y- + Z2可以发生
难度: 中等查看答案及解析
-
下列说法中,有错误的是。
A. Na2CO3溶液能与石灰水反应,而NaHCO3溶液不能与石灰水反应
B. 相同条件下,NaHCO3溶解度小于Na2CO3
C. Na2CO3很稳定,而NaHCO3受热时容易分解
D. 将等物质的量的NaHCO3粉末与Na2CO3粉末同时分别倒入适量的相同浓度的稀
难度: 中等查看答案及解析
-
离子方程式BaCO3+2H+===CO2↑+H2O+Ba2+中的H+不能代表的物质
①HCl ②H2SO4 ③HNO3 ④NaHSO4 ⑤CH3COOH
A. ①③ B. ②④⑤ C. ①④⑤ D. ①⑤
难度: 中等查看答案及解析
-
下列各组物质相互混合反应后,最终有白色沉淀生成的是
①金属钠投入到FeCl3溶液中 ②过量CO2通入澄清石灰水 ③向硫酸钠溶液中加入BaCl2 ④少量Ca(OH)2投入过量NaHCO3溶液中 ⑤向饱和Na2CO3溶液中通入足量CO2
A. ①③④⑤ B. ①④
C. ②③ D. ③④⑤
难度: 中等查看答案及解析
-
下列各组中的离子,能在溶液中大量共存的是
A. H+ Na+ CO32- Cl- B. Ba2+ Na+ Cl- SO42-
C. K+ H+ SO42- OH- D. Ag+ Al3+ NO3- H+
难度: 中等查看答案及解析
-
在体积为V L的密闭容器中通入a mol CO和b mol O2,点燃充分反应后容器内碳原子数和氧原子数之比为( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
下列离子方程式改写成化学方程式正确的是
A. Mg2++2OH- = Mg(OH)2↓ MgSO4+Ba(OH)2 = Mg(OH)2↓+BaSO4↓
B. Fe+Cu2+ = Fe2++Cu Fe+Cu(OH)2 = Fe(OH)2+Cu
C. Ag++Cl- = AgCl↓ AgNO3+HCl = AgCl↓+HNO3
D. CO2+2OH- = CO32-+H2O CO2+Ca(OH)2 = CaCO3↓+H2O
难度: 中等查看答案及解析
-
将质量相同的Na、Mg、Al、Fe、Zn分别投入足量的稀HCl中,则这些金属与酸反应生成H2的在相同条件下体积由大到小的顺序是
A. Zn>Fe>Na>Mg>Al B. Al>Mg>Na>Fe>Zn
C. Na>Mg>Al>Fe>Zn D. Fe>Zn>Mg>Al>Na
难度: 中等查看答案及解析