-
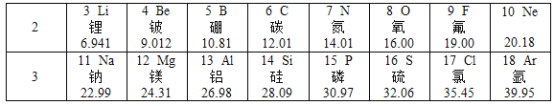
根据“原子量”递增的顺序,绘制了第一张元素周期表的科学家是
A.
 卢瑟福 B.
卢瑟福 B.  拉瓦锡 C.
拉瓦锡 C.  门捷列夫 D.
门捷列夫 D.  道尔顿
道尔顿难度: 简单查看答案及解析
-
下列属于物理变化的是
A.蜡烛燃烧
B.海水蒸发
C.钢铁生锈
D.粮食酿酒
难度: 简单查看答案及解析
-
下列属于氧化物的是
A.氧气
B.硝酸铵
C.氯化钾
D.氧化钙
难度: 简单查看答案及解析
-
下列各组气体目前均计入空气质量评价的主要污染物的是
A.一氧化碳、臭氧、二氧化硫
B.氮气、一氧化碳、二氧化硫
C.二氧化碳、氮气、二氧化硫
D.二氧化碳、二氧化硫、一氧化碳
难度: 简单查看答案及解析
-
下列各物质中,氯元素的化合价最低的是( )
A.ClO2 B.HClO C.NaCl D.Cl2
难度: 简单查看答案及解析
-
洗涤在生活、生产中不可缺少。下列洗涤方法中利用了乳化原理的是
A.用汽油洗去手上的油污
B.用酒精洗去试管中的碘
C.用洗洁精洗去餐具上的油污
D.用稀盐酸洗去盛石灰水试剂瓶壁上的白色固体
难度: 简单查看答案及解析
-
下列大小关系正确的
A.粒子的大小:分子>原子
B.地壳中元素的含量: Al<Fe
C.分子间的间隔:氧气>液氧
D.双氧水加二氧化锰产生氧气后,其中二氧化锰的质量:反应前<反应后
难度: 中等查看答案及解析
-
下列实验现象的描述,正确的是
A.木炭伸入盛有氧气的集气瓶中剧烈燃烧,发出白光
B.铁在空气中剧烈燃烧,火星四射,生成黑色固体
C.红磷在空气中燃烧产生大量白色烟雾
D.硫粉在氧气中燃烧发出蓝紫色火焰
难度: 简单查看答案及解析
-
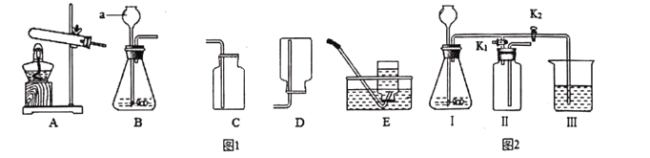
某化学实验小组用如图所示的实验装置进行相关实验,集气瓶中先装入Y试剂,然后从胶头滴管中滴加x, (X的体积忽略不计)下列判断不正确的是

A.若X为水,Y为硝酸铵,则乙瓶中右端导管内液面下降
B.若X为稀盐酸,Y为镁,则乙瓶中右端导管内液面上升
C.若乙瓶中右端导管内液面上升,Y为水,则X可能为氢氧化钠溶液
D.若乙瓶中右端导管内液面上升,Y为生石灰,则X可能为水
难度: 困难查看答案及解析
-
现有A、B、C三种物质各15g,充分反应后生成D物质30g,此时C已完全反应,若再加入C物质5g,A恰好完全反应,则参加反应的A与B的质量比为
A.3:2
B.3:1
C.1:1
D.2:3
难度: 困难查看答案及解析
-
氧烛是一种用于缺氧环境中自救的化学氧源,广泛用于航空、航海等领域,其主要成分为NaClO3,还含有适量的催化剂、成型剂等。氧烛通过撞击火帽引发反应后,能持续放出高纯氧气,主要反应原理为2NaClO3═2NaCl+3O2↑.一根氧烛大约可以供100个人呼吸1小时。下列说法不正确的是( )
A. 氧烛是一种纯净物
B. NaClO3中Cl为+5价
C. 氧烛制取氧气的反应为分解反应
D. 在运输氧烛时,应避免其受到撞击
难度: 中等查看答案及解析
-
下列实验方案设计正确的是
选项
实验目的
实验方案
A
除去二氧化碳中的少量一氧化碳
将混合气体通过足量的灼热氧化铜
B
鉴别氮气和二氧化碳
将燃着的木条分别伸入集气瓶中
C
除去硫酸锌溶液中的少量硫酸铜
加入足量铁粉,过滤
D
除去铜粉中混有的少量碳粉
将混合物在空气中充分灼烧
A.A B.B C.C D.D
难度: 困难查看答案及解析