-
下列与化学反应能量变化相关的叙述正确的是
A. 干冰气化需要吸收大量的热,这个变化是吸热反应
B. 反应物的总能量低于生成物的总能量时,发生放热反应
C. 化学反应中的能量变化都表现为热量的变化
D. 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H相同
难度: 中等查看答案及解析
-
人类将在未来逐渐由“碳素燃料文明时代”过渡至“太阳能文明时代”(包括风能、生物质能等太阳能转换形态),届时人们将适应“低碳经济”和“低碳生活”。下列说法错误的是( )
A. 煤、石油和天然气都属于碳素燃料
B. 发展太阳能经济有助于减缓温室效应
C. 太阳能电池可将太阳能直接转化为电能
D. 目前研究菠菜蛋白质“发电”不属于“太阳能文明”
难度: 简单查看答案及解析
-
下列反应中,既属于氧化还原反应又属于吸热反应的是( )
A. Ba(OH)2·8H2O与NH4Cl反应 B. 工业合成氨
C. 灼热的炭与CO2反应 D. 葡萄糖在人体内生理氧化
难度: 简单查看答案及解析
-
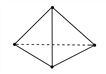
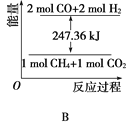
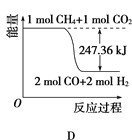
下列各图中,表示吸热反应的是( )
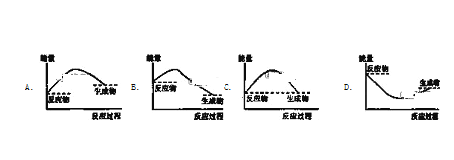
A. A B. B C. C D.
难度: 中等查看答案及解析
-
某反应的反应过程中的能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能),下列有关叙述中正确的是( )
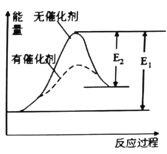
A. 上图可表示由KClO3加热制O2反应过程中的能量变化
B. 催化剂能改变该反应的焓变
C. 催化剂能改变该反应的正反应的活化能而对逆反应的活化能无影响
D. 该反应为放热反应
难度: 中等查看答案及解析
-
反应:A(气)+3B(气)
2C(气); ΔH<0达平衡后,将气体混合物的温度降低,下列叙述中正确的是( )
A. 正反应速率加大,逆反应速率变小,平衡向正反应方向移动
B. 正反应速率变小,逆反应速率加大,平衡向逆反应方向移动
C. 正反应速率和逆反应速率都变小,平衡向正反应方向移动
D. 正反应速率和逆反应速率都变小,平衡向逆反应方向移动
难度: 中等查看答案及解析
-
一定温度下,可逆反应A2(g)+B2(g)⇌2AB(g)达到平衡状态的标志是( )
A. 单位时间内生成 n mol A2,同时生成 n mol AB
B. 单位时间内生成2n mol AB的同时生成n mol B2
C. 体系内的总压不随时间变化
D. 单位时间内生成 n mol A2的同时,生成n mol B2
难度: 中等查看答案及解析
-
下列依据热化学方程式得出的结论正确的是
A.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
B.已知C(s)+O2(g)=CO2(g) ΔH1 C(s)+1/2O2(g)=CO(g);ΔH2,则ΔH2>ΔH1
C.已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol
D.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ/mol,则含20 g NaOH的稀溶液与稀盐酸完全中和,中和热为28.65 kJ/mol
难度: 中等查看答案及解析
-
(原创)下列说法不正确的是( )
A.中和热测定实验中,应迅速将NaOH溶液和盐酸在测定装置中混合
B.为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可
C.探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL 5%H2O2和1mL H2O,向另一支试管中加入2mL 5%H2O2和1mL FeCl3溶液,观察并比较实验现象
D.已知
,为了利用该反应探究反应速率与温度的关系,所用试剂除1 mol·L-1KI溶液、0.1 mol·L-1稀硫酸外,还需要用到淀粉溶液
难度: 中等查看答案及解析
-
下列事实中,不能用平衡移动原理解释的是
A. 开启啤酒瓶后,瓶中马上泛起大量泡沫
B. 由H2、I2(g)、HI组成的平衡体系,加压后颜色加深
C. 实验室中常用排饱和食盐水的方法收集氯气
D. 工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
难度: 中等查看答案及解析
-
强酸与强碱的稀溶液发生中和反应的热效应为H+(aq)+OH-(aq)
H2O(l) ΔH=-57.3 kJ·mol-1。稀醋酸、浓硫酸、稀硝酸分别与0.1mol·L-1的NaOH溶液恰好完全反应,放出的热量与消耗NaOH溶液的体积之间的关系如图所示(CH3COOH电离要吸热)。则下列描述正确的是( )
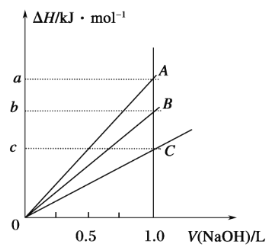
A. A表示稀硝酸与NaOH溶液的反应
B. B表示稀醋酸与NaOH溶液的反应
C. b=5.73
D. C表示浓硫酸与NaOH溶液的反应
难度: 中等查看答案及解析
-
在FeCl3溶液中滴加无色的KSCN溶液后,有以下可逆反应存在:
FeCl3+3KSCN
Fe(SCN)3+3KCl。已知Fe(SCN)3呈红色,则在该平衡体系中加入少量KCl晶体后(忽略溶液体积的变化),红色将
A. 变深 B. 变浅 C. 不变 D. 无法确定
难度: 简单查看答案及解析
-
已知:2H2(g)+O2(g)
2H2O(g) △H1
3H2(g)+Fe2O3(s)
2Fe(s)+3H2O(g) △H2
2Fe(s)+3/2O2(g)
Fe2O3(s) △H3
2Al(s)+3/2O2(g)
Al2O3(s) △H4
2Al(s)+Fe2O3(s)
A12O3(s)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的是
A. △H1<0,△H3>0 B. △H5<0,△H4<△H3
C. △H1=△H2+△H3 D. △H3=△H4+△H5
难度: 中等查看答案及解析
-
一定温度下,在固定体积的密闭容器中发生下列反应:2HI === H2+I2。若c(HI)由0.1mol·L-1 降到0.07mol·L-1 时,需要15s,那么c(HI)由0.07mol·L-1降到0.05mol·L-1时,所需反应的时间为( )
A. 大于10s B. 10s C. 小于10s D. 无法确定
难度: 中等查看答案及解析