-
已知反应FeO(s)+C(s)=CO(g)+ Fe(s) 的△H>0,△S >0(假定△H、△S不随温度而变化),下列叙述中正确的是( )
A. 低温下为自发过程,高温下为非自发过程 B. 高温下为自发过程,低温下为非自发过程
C. 任何温度下均为非自发过程 D. 任何温度下均为自发过程
难度: 中等查看答案及解析
-
在一定的温度和压强下,水成为“超临界状态”,此时水可将CO2等含碳化合物转化为有机物,这就是“水热反应”。生物质在地下高温高压条件下通过水热反应可生成石油、煤等矿物能源。下列说法错误的是
A. 二氧化碳与超临界水作用生成汽油的反应,属于放热反应
B. “水热反应”是一种复杂的化学变化
C. 火力发电厂可望利用废热,将二氧化碳转变为能源物质
D. 随着科技的进步,“水热反应”制取能源有望实现地球上碳资源的和谐循环
难度: 中等查看答案及解析
-
实验测得25℃、101 kPa时,1 mol甲醇完全燃烧释放726.51kJ的热量,下列热化学方程式书写正确的是( )
A. 2CH3OH+3O2=2CO2+4H2O ΔH=-1453.02 kJ·mol-1
B. 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=+1453.02 kJ·mol-1
C. CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) ΔH=-726.51 kJ·mol-1
D. CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-726.51 kJ·mol-1
难度: 中等查看答案及解析
-
已知:H2(g)+F2(g)=2HF(g)的能量变化如图所示,有关叙述中不正确的是( )
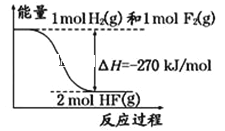
A. 氟化氢气体分解生成氢气和氟气的反应是吸热反应
B. 1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ
C. 在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量
D. 断裂1 mol H﹣H键和1 mol F﹣F 键吸收的能量小于形成2 mol H﹣F键放出的能量
难度: 中等查看答案及解析
-
有关热化学方程式书写与对应关系表述均正确的是
A.稀醋酸与0.1mol•L-1NaOH溶液反应:H+(aq)+OH-(aq)=H2O(l)△H=+57.3 kJ•mol-1
B.在101KPa下氢气的燃烧热△H=-285.5 kJ•mol-1,则水分解的热化学方程式:2H2O(l)=2H2(g)+O2(g)△H=+285.5 kJ•mol-1
C.密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量.则Fe(s)+S(s)=FeS(s)△H=-95.6 kJ•mol-1
D.已知2C(s)+O2(g)=2CO(g)△H=-221 kJ•mol-1,则可知C的燃烧热为110.5 kJ•mol-1
难度: 中等查看答案及解析
-
通过以下反应可获得新型能源二甲醚(CH3OCH3 )。下列说法不正确的是
①C(s) + H2O(g)==CO(g) + H2 (g) ΔH1 = akJ·mol−1
②CO(g) + H2O(g)==CO2(g) + H2 (g) ΔH2 = bkJ·mol−1
③CO2 (g) + 3H2 (g)==CH3OH(g) + H2O(g) ΔH3 = ckJ·mol−1
④2CH3OH(g)==CH3OCH3 (g) + H2O(g) ΔH4 = dkJ·mol−1
A. 反应①、②为反应③提供原料气
B. 反应③也是CO2资源化利用的方法之一
C. 反应CH3OH(g)==
CH3OCH3 (g) +
H2O(l)的ΔH =
kJ·mol−1
D. 反应2CO(g) + 4H2 (g)==CH3OCH3 (g) + H2O(g)的ΔH = ( 2b + 2c + d ) kJ·mol−1
难度: 简单查看答案及解析
-
N2(g)与H2(g)在铁催化剂表面经历如图所示过程生成NH3,下列说法正确的是
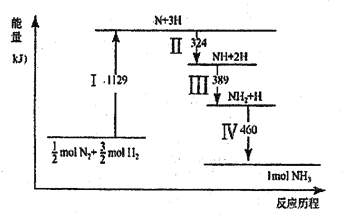
A. Ⅰ中破坏的均为极性键
B. Ⅱ、Ⅲ、Ⅳ均为放热过程
C. Ⅳ中NH2与H2生成NH3
D. N2(g)+3H2(g)
2NH3(g) ΔH>0
难度: 中等查看答案及解析
-
在373K时,把0.5mol N2O4气体通入体积为5L的恒容密闭容器中,立即出现红棕色。反应进行到2秒时,NO2的浓度为0.02 mol/L。在60秒时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法正确的是( )
A. 前2秒,以N2O4的浓度变化表示的平均反应速率为0.01mol/(L·s)
B. 在2秒时体系内的压强为开始时的1.2倍
C. 在平衡时体系内含N2O40.20mol
D. 平衡时,如果再充入一定量N2O4, 则可提高N2O4的转化率
难度: 困难查看答案及解析
-
向某密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体, 一定条件下发生如下反应: 3A(g)
B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是( )
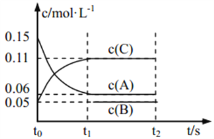
A. 若 t1=15 s,则用 A 的浓度变化表示 t0~t1阶段的平均反应速率为 0.004 mol·L-1·s-1
B. t1时该反应达到平衡,A的转化率为 60%
C. 该容器的容积为2 L,B的起始的物质的量为 0.02 mol
D. t0~t1 阶段,此过程中容器与外界的热交换总量为 a kJ,该反应的热化学方程式为 3A(g)
B(g)+2C(g) ΔH=-50a kJ·mol-1
难度: 困难查看答案及解析
-
H2O2分解速率受多种因素影响。实验测得 70℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是
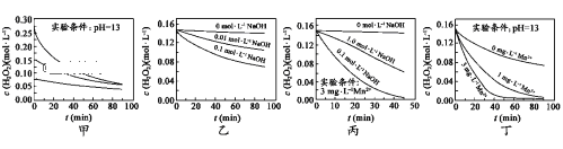
A. 图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B. 图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C. 图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
D. 图丁表明,碱性溶液中,Mn2+越大,H2O2分解速率越快
难度: 中等查看答案及解析
-
下列事实不能用勒夏特列原理(平衡移动原理)解释的是
①溴水中存在化学平衡:Br2+H2O
HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
②铁在潮湿的空气中易生锈
③二氧化氮与四氧化二氮的平衡体系,增大压强后颜色加深
④合成氨反应,为提高氨的产率,理论上应采取降低温度的措施
⑤钠与氯化钾共融制备钾:Na(l)+KCl(l)
K(g)+NaCl(l)
⑥反应CO(g)+NO2(g)
CO2(g)+NO(g)(正反应为放热反应),达到化学平衡后,升高温度体系的颜色加深
A. ①④ B. ②③ C. ②⑥ D. ②③⑥
难度: 中等查看答案及解析
-
将NO2装入带活塞的密闭容器中,当反应2NO2(g)
N2O4(g)达到平衡后,改变下列一个条件,其中叙述正确的是
A. 升高温度,气体颜色加深,则此反应为吸热反应
B. 慢慢压缩气体体积,平衡向右移动,混合气体颜色变浅
C. 慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍
D. 恒温恒容时,充入惰性气体,压强增大,平衡向右移动,混合气体的颜色变浅
难度: 中等查看答案及解析
-
已知N2O4(无色)
2NO2(红棕色) 现有如右图所示的三个烧瓶,分别充满NO2气体并分别放置在盛有下列物质的烧杯(烧杯内有水)中:在(I)中加入无水CaO,在(III)中加入NH4Cl晶体,(II)中不加其他任何物质,发现(I)中红棕色变深,(III)中红棕色变浅,下列叙述正确的是 ( )
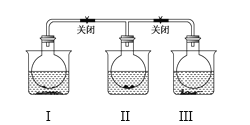
A. CaO溶于水时吸收热量 B. 该反应的ΔH>0
C. NH4Cl溶于水时放出热量 D. 烧瓶(III)中气体的压强增大
难度: 中等查看答案及解析
-
乙酸蒸气能形成二聚分子:2CH3COOH(g)
(CH3COOH)2(g) (正反应放热)。现欲测定乙酸的相对分子质量,应采用的反应条件是( )
A. 低温高压 B. 高温低压 C. 低温低压 D. 高温高压
难度: 简单查看答案及解析
-
在0.1 mol/LCH3COOH溶液中存在如下电离平衡:CH3COOH
CH3COO-+H+,对于该平衡下列叙述正确的是
A. 加入水时,平衡逆向移动
B. 加入少量NaOH固体,平衡正向移动
C. 加入少量0.1 mol/L 盐酸,溶液中c(H+)减小
D. 加入少量CH3COONa固体,平衡正向移动
难度: 中等查看答案及解析
-
下列事实不能证明CH3COOH是弱酸的是( )
A. CH3COOH溶液能使石蕊试液变红
B. 0.1 mol/L的CH3COOH,H+浓度为0.01 mol/L
C. 等物质的量浓度的CH3COOH导电能力比盐酸弱
D. 0.01 mol/L的CH3COOH溶液中有两种分子存在
难度: 简单查看答案及解析
 ΔH=+88.6 kJ·mol-1
ΔH=+88.6 kJ·mol-1