-
氟化锂(LiF)难溶于水,可用于核工业、光学玻璃制造等。以透锂长石(含Li2O、Al2O3、SiO2)为原料制备氟化锂的工艺流程如下:
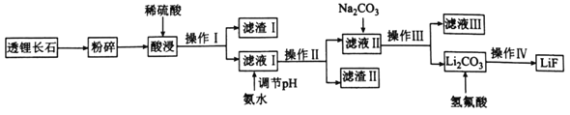
回答下列问题:
(1)滤液I中含有的金属离子有________,滤渣I的一种用途是________________。
(2)滤渣Ⅱ是目前应用最广泛的无机阻燃剂,写出生成滤渣Ⅱ的离子方程式:________________。常温下,若向滤液I中滴加氨水调节pH=5时,溶液中c(Al3+)=________mol·L-1,则溶液中A13+________(填“是”或“否”)沉淀完全(已知Ksp[Al(OH)3]=2.0×10-33,且溶液中的离子浓度小于1.0×10-5mol·L-1时沉淀完全)。
(3)操作Ⅳ包括________________、________________和干燥。
(4)写出Li2CO3与氢氟酸反应的化学方程式:________________________,该反应不能在玻璃容器中进行的原因是________________________(用化学方程式表示)。
-
氨是一种重要的化工原料,可以用来制备氮化硅(Si3N4)肼(N2H4)、氢氰酸(HCN)。
(1)已知:Si(s)+2Cl2(g)====SiCl4(g) △H1=akJ·mol-1
N2(g)+3H2(g)  2NH3(g) △H2=bkJ·mol-1
2NH3(g) △H2=bkJ·mol-1
3Si(s)+2N2(g)====Si3N4(s) △H3=ckJ·mol-1
H2(g)+Cl2(g)====2HCl(g) △H4=dkJ·mol-1
则反应3SiCl4(g)+4NH3(g)====Si3N4(s)+12HCl(g)的△H=________________kJ·mol-1(用a、b、c、d表示)。
(2)肼的制备方法是用次氯酸钠氧化过量的氨。
已知ClO-水解的方程式为:ClO-+H2 O=HClO+OH-。常温下,该水解反应的平衡常数为K=1.0×10-6mol·L-1,则1.0mol· L -1NaCIO溶液的pH=________。
(3)工业上利用氨气生产氢氰酸(HCN)的反应为:CH4(g)+NH3(g)  HCN(g)+3H2 (g) △H>O
HCN(g)+3H2 (g) △H>O
①其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图所示。X代表的是________(填“温度”或“压强”)。
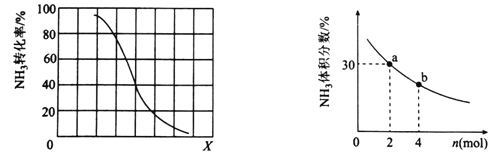
②其他条件一定,向2L密闭容器中加人 n mol CH4和2 mol NH3,平衡时NH3体积分数随n变化的关系如图所示。若反应从开始到a点所用时间为10min,该时间段内用CH4的浓度变化表示的反应速率为________mol·L-1·min-1;平衡常数:K(a) ________K(b)(填“>”“=”或“<”)
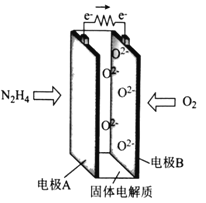
③工业上用电解法处理含氰电镀废水(pH=10)的装置如图所示。
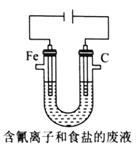
阳极产生的氯气与碱性溶液反应生成ClO-,ClO-将CN-氧化的离子方程式为:_____CN-+ _____ClO-+ ________====_____CO32-+_____N2↑+________+________若电解处理2 mol CN-,则阴极产生气体的体积(标准状况下)为________L。
-
[化学——选修3:物质结构与性质]硼及其化合物用途非常广泛,回答下列问题。
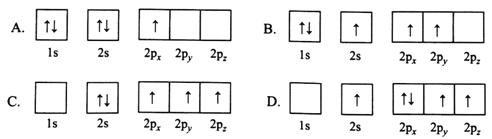
(1)下列B原子电子排布图表示的状态中,能量最低和最高的分别为________、________(填标号)
(2)H3BO3是一元弱酸,可用作医用消毒剂其水溶液呈酸性的原理为:
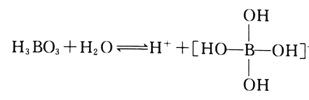
则1mol硼酸分子中含有的共用电子对数为________个。
(3)BF3可用于制造火箭的高能燃料,其分子的空间构型是________________,硼原子杂化方式是________________;BF3能与乙醚发生反应:(C2H5)2O+BF3→BF3·O(C2H5)2,该反应能发生,其原因是________________________________。
(4)硼的一种化合物结构简式为O=B—CH=C=CH2,该分子中含________个σ键。
(5)下图中图(a)为类似石墨的六方BN,图(b)为立方BN。
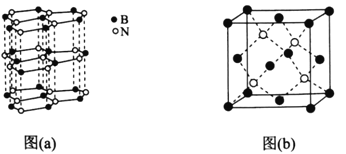
①六方BN具有良好的润滑性,是因为________________________;六方BN不能像石墨一样具有导电性,其原因是________________________。
②已知立方BN的晶胞参数为0.3615nm,阿伏加德罗常数的值为NA,则立方BN的密度为________________g·cm-3(列出计算式)。
-
[化学——选修5:有机化学基础]化合物J是制备降血脂药贝利贝特的中间体,制备J的一种合成路线设计如下:
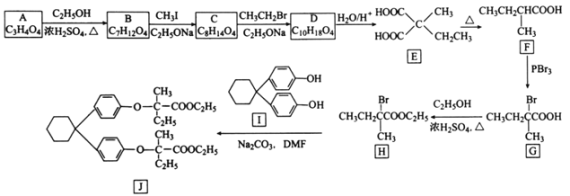
回答下列问题:
(1)A的化学名称是________________。
(2)G生成H的反应类型是________________;J的分子式为________________。
(3)C的结构简式为________________________。
(4)化合物I可由芳香化合物C6H6O和环状化合物C6H10O在醋酸和盐酸催化下制备得到,该反应的化学方程式为________________________________________。
(5)R与E互为同分异构体且与E具有相同的官能团种类和数目,则R的结构有________种。其中对应的核磁共振氢谱图中有四组峰,且峰面积比为4:3:2:1的结构简式为________。
(6)苯氧乙酸乙酯(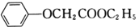 )是一种农药,设计由苯酚和乙醇为起始原料制备苯氧乙酸乙酯的合成路线:________________(无机试剂任选)。
)是一种农药,设计由苯酚和乙醇为起始原料制备苯氧乙酸乙酯的合成路线:________________(无机试剂任选)。
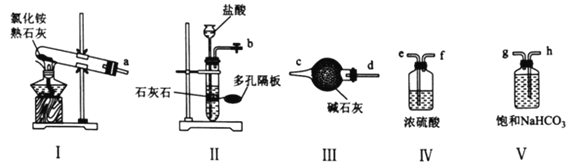
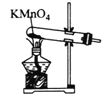 制备氧气 B.
制备氧气 B.  收集氧气
收集氧气 固体溶解 D.
固体溶解 D. 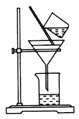 过滤操作
过滤操作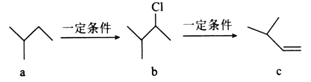





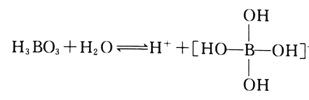


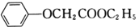 )是一种农药,设计由苯酚和乙醇为起始原料制备苯氧乙酸乙酯的合成路线:________________(无机试剂任选)。
)是一种农药,设计由苯酚和乙醇为起始原料制备苯氧乙酸乙酯的合成路线:________________(无机试剂任选)。