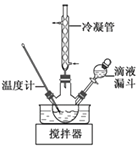
-
化学与生活、生产密切相关,下列说法错误的是 ( )
A. Ge(32号元素)的单晶可以作为光电转换材料用于太阳能电池
B. 工业生产玻璃、水泥,均需要用石灰石为原料
C. 将二氧化硫添加于红酒中可以起到杀菌和抗氧化作用
D. 纳米铁粉和FeS都可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其原理是相同的。
难度: 中等查看答案及解析
-
硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如下图),下列说法错误的是( )
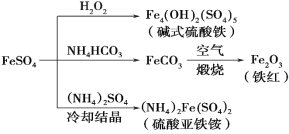
A. 碱式硫酸铁水解能产生Fe(OH)3胶体,可用做净水剂
B. 为防止NH4HCO3分解,生产FeCO3需在较低温度下进行,该反应的离子方程式为:Fe2++2HCO3-= FeCO3+ CO2↑+H2O
C. 可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D. 该温度下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
难度: 中等查看答案及解析
-
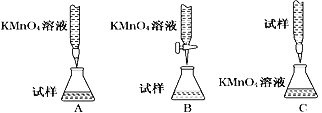
如表实验操作、现象与结论对应关系正确的是( )
选项
实验操作
实验现象
结论
A
先向2mL0.1mol/LNa2S溶液中滴几滴0.1mol/LZnSO4溶液,再加入几滴0.1mol/LCuSO4溶液
开始有白色沉淀生成;后又有黑色沉淀生成
Ksp(ZnS)<Ksp(CuS)
B
向含有酚酞的Na2CO3溶液中加入少量BaC12固体,
溶液红色变浅
证明Na2CO3溶液中存在水解平衡
C
等体积pH=2的HX和HY两种酸分别与足量的铁反应,排水法收集气体
HX放出的氢气多且反应速率快
HX酸性比HY强
D
分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH
后者较大
证明非金属性
S>C
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增加。A是元素Y的单质。常温下,甲的浓溶液和A发生钝化。丙、丁、戊是由这些元素组成的二元化合物,且丙是无色气体。上述物质的转化关系如图所示。下列说法正确的是
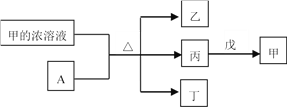
A. 丁和戊中所含元素种类相同
B. 简单离子半径大小:X<Y
C. 气态氢化物的还原性:X>Z
D. Y的简单离子与Z的简单离子在水溶液中可大量共存
难度: 中等查看答案及解析
-
以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备 Fe(OH)2,装置如图所示,其中电解池两极材料分别为铁和石墨,通电一段时间后,右侧玻璃管中产生大量的白色沉淀。则下列说法正确的是( )
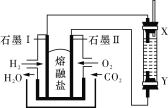
A. 石墨电极Ⅱ处的电极反应式为O2+4e-===2O2-
B. X是铁电极
C. 电解池中有1mol Fe溶解,石墨Ⅰ耗H2 22.4 L
D. 若将电池两极所通气体互换,X、Y两极材料也要互换。
难度: 中等查看答案及解析
-
在给定条件下,下列离子组的离子共存判断及反应的离子方程式均正确的是( )
选项
条件
离子组
离子共存判断及的离子方程式
A
c(OH-)c(H+)=1酸性溶液中
Fe2+、NO3-、Al3+、CO32-
不能大量共存,3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
B
由水电离出c(H+)
=1×10-13mol·L-1
K+、NH4+、Cl-、[Al(OH)4]-
能大量共存
C
有大量Fe3+的溶液
Na+、NH4+、SO42-、Cl-
能大量共存
D
通入少量SO2气体
K+、Na+、ClO-、SO42-
不能大量共存,2ClO-+SO2+H2O=2HClO+SO32-
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)
CH3OH(g) △H<0,在容积为1 L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法不正确的是( )

A. H2转化率:a>b>c
B. 上述三种温度之间关系为T1>T2>T3
C. a点状态下再通入0.5 mol CO和0.5 molCH3OH,平衡不移动
D. c点状态下再通入1 molCO和4 mol H2,新平衡中H2的体积分数减小
难度: 中等查看答案及解析