重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。已知部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
I.某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:
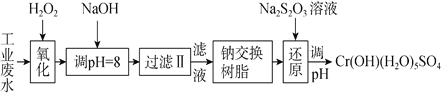
(1)氧化过程中可代替H2O2加入的试剂是________(填序号)。
a.Na2O2 b.HNO3 c.FeCl3 d.KMnO4
(2)加入NaOH溶液调溶液pH=8时,除去的离子是________(填序号);已知钠离子交换树脂的原理:Mn++nNaRMRn+nNa+,此步操作被交换除去的杂质离子__________(填序号)。
a.Fe3+ b.Al3+ c.Ca2+ d.Mg2+
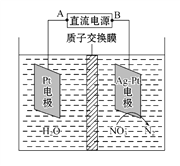
II.酸性条件下,铬元素主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水。该法用Fe、石墨分别作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3和Fe(OH)3
(3)电解时连接铁棒的一极是电源的_________极。
(4)写出电解时阳极的电极反应式____________________;阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为______________________________;
(5)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为________时才能使c(Cr3+)降至1×10-5 mol•L-1
氢气是一种新型的绿色能源,又是一种重要的化工原料。以生物材质(以C 计)与水蒸气反应制取H2是一种低耗能,高效率的制H2方法。该方法由气化炉制造H2和燃烧炉再生CaO两步构成。气化炉中涉及到的反应为:
I.C(s)+H2O(g) CO(g)+H2(g) K1;
CO(g)+H2(g) K1;
Ⅱ.CO(g)+H2O(g) CO2(g)+H2(g) K2;
CO2(g)+H2(g) K2;
Ⅲ.CaO(s)+CO2(g) CaCO3(s) K3;
CaCO3(s) K3;
(1)该工艺制H2总反应可表示为C(s)+2H2O(g)+CaO(s) CaCO3(s)+2H2(g),其反应的平衡常数K=_______________(用K1、K2、K3的代数式表示)。在2L的密闭容器中加入一定量的C(s)、H2O(g)和CaO(s)。下列能说明反应达到平衡状态的是__________。
CaCO3(s)+2H2(g),其反应的平衡常数K=_______________(用K1、K2、K3的代数式表示)。在2L的密闭容器中加入一定量的C(s)、H2O(g)和CaO(s)。下列能说明反应达到平衡状态的是__________。
a.容器内混合物的质量不变 b.H2与H2O(g)的物质的量之比不再变化
c.混合气体的密度不再变化 d.形成 a mol H-H键的同时断裂 2 amol H-O键
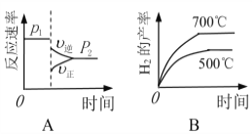
(2)对于反应Ⅰ,不同温度和压强对H2产率影响如下表。
| 压强 温度 | p1/Mpa | p2/Mpa |
| 500℃ | 45.6% | 51.3% |
| 700℃ | 67.8% | 71.6% |
由表中数据判断:p1 ______ p2(填“>”、“<”或“=”)
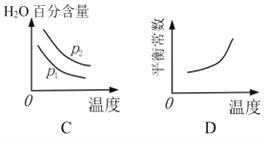
下列图像正确的是_________。
(3)已知反应Ⅱ的△H= -41.1 kJ/mol, C=O、O-H、H-H的键能分别为803kJ/mol,464 kJ/mol、436 kJ/mol,则 CO中碳氧键的键能为___________ kJ/mol。
(4)对于反应Ⅲ,若平衡时再充入CO2,使其浓度增大到原来的2倍,则平衡向_____________(填“正反应”、“逆反应”)方向移动;当重新平衡后,CO2浓度_________(填“变大”、“变小”或“不变”)。
不变