-
下列变化属于物理变化的是
A. 钝化 B. 风化 C. 干馏 D. 分馏
难度: 简单查看答案及解析
-
下列氮原子结构的表述中,对电子运动状态描述正确且能表明同一电子层电子能量有差异的是
A.
B.
C.1s22s22p3
D.
难度: 中等查看答案及解析
-
下列关于同温同压同体积的16O2和18O2的判断正确的是
A. 质子数相同 B. 沸点相同 C. 互为同位素 D. 摩尔质量相同
难度: 简单查看答案及解析
-
下列分子中,属于含有极性键的非极性分子的是
A. C2H4 B. H2S C. Cl2 D. NH3
难度: 简单查看答案及解析
-
葡萄糖发酵产生乳酸,其结构简式如图所示,乳酸不能发生的反应类型是
A. 取代 B. 消去
C. 加成 D. 聚合
难度: 简单查看答案及解析
-
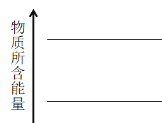
下列反应中生成物总能量高于反应物总能量的是 ( )
A.氧化钙溶于水 B.铁粉与硫粉共热
C.强酸强碱中和 D.碳酸钙分解
难度: 简单查看答案及解析
-
下列实验事实可以用共价键键能解释的是
A. 氯化氢的沸点低于溴化氢 B. 金刚石熔点高于晶体硅
C. 氦气的化学性质稳定 D. 甲烷是正四面体型分子
难度: 中等查看答案及解析
-
关于NH4Cl的说法正确的是
A. 溶于水温度升高 B. 可作氮肥
C. 受热分解可制氨气 D. 属于共价化合物
难度: 简单查看答案及解析
-
下列事实不能说明元素的金属性或非金属性相对强弱的是
A. 氧化性:Cu2+>Fe2+ B. 酸性:HI>HCl
C. 共用电子对偏移程度:N-H键>C-H键 D. 碱性:NaOH>Al(OH)3
难度: 简单查看答案及解析
-
下列有机物实验室制备装置正确的是
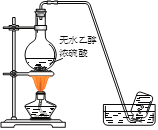
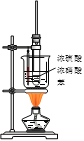
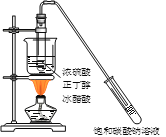
A.制乙烯
B.制乙炔
C.制硝基苯
D.制乙酸丁酯
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
某单烯烃与氢气的加成产物为:CH3CH2CH(CH3)CH2CH3 ,下列相关说法正确的是
A. 该产物的名称是2-乙基丁烷
B. 该产物有3种沸点不同的一氯代物
C. 原单烯烃只可能有3种不同结构
D. 原单烯烃与分子式为C5H10的烃一定互为同系物
难度: 中等查看答案及解析
-
水中加入下列物质,对水的电离平衡不产生影响的是
A. NaHCO3 B. NaBr C. KAl(SO4)2 D. NH3
难度: 中等查看答案及解析
-
加热条件下,20 mL 18 mol/L的浓H2SO4与过量的碳反应,可得到标况下的CO2
A. 小于4.032L B. 等于4.032L C. 大于4.032L D. 无法确定
难度: 简单查看答案及解析
-
向H2S溶液中加入或通入少量下列物质,溶液pH上升且c(S2-)降低的是
A. NaOH B. CuSO4 C. Cl2 D. SO2
难度: 中等查看答案及解析
-
将物质的量浓度和体积均相同的一元酸HA 与一元碱BOH 混合,所得溶液呈碱性。下列判断正确的是
A. BOH一定过量 B. HA一定不是强酸
C. BOH一定是强碱 D. 所得溶液:c(A-) >c(B+)
难度: 中等查看答案及解析
-
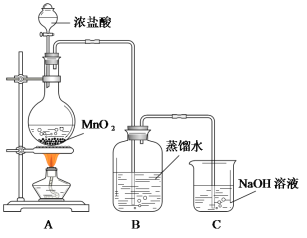
下列鉴别浓硫酸和稀硫酸的实验操作与结论有误的是
实验操作
结论
A
分别加入铁片
无气体产生者为浓硫酸
B
分别滴加到胆矾晶体中
晶体变白者为浓硫酸
C
分别滴加到pH试纸上
试纸变黑者为浓硫酸
D
将蘸有浓氨水的玻璃棒靠近酸的瓶口
有白烟生成的是浓硫酸
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
由一种阳离子与两种酸根离子组成的盐称为混盐。向混盐CaOCl2中加入足量浓硫酸,可发生反应:CaOCl2 + H2SO4(浓)→CaSO4 + Cl2↑+ H2O。下列说法错误的是(NA表示阿佛加德罗常数)
A. 浓硫酸体现氧化性与酸性
B. 1 mol混盐CaOCl2中含有3NA个离子
C. 混盐CaOCl2中既含离子键又含共价键
D. 每产生1mol氯气,转移电子数为NA
难度: 中等查看答案及解析
-
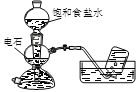
用滴有氯化钠溶液的湿润的滤纸分别做甲、乙两个实验,下列判断正确的是
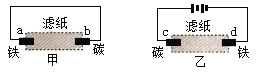
A. a极上发生还原反应
B. 铁片腐蚀速率:乙>甲
C. d为阴极,发生的反应为:Fe-2e→Fe2+
D. b极上发生的反应为:O2 + 2H2O + 4e → 4OH—
难度: 中等查看答案及解析
-
某溶液含有五种离子,且各离子物质的量浓度相等(不考虑水解与电离),已知其中三种离子为Na+、I—、NO3—,则另外两种离子可能是
A. Ba2+和OH— B. K+和AlO2— C. Fe3+和SO42— D. H+和Cl—
难度: 中等查看答案及解析
-
下列实验操作或现象不能用勒沙特列原理解释的是


A.卤化银沉淀的转化
B.配制FeCl3溶液


C.酯水解程度比较
D.探究石灰石与稀盐酸在密闭环境下的反应
A. A B. B C. C D. D
难度: 中等查看答案及解析
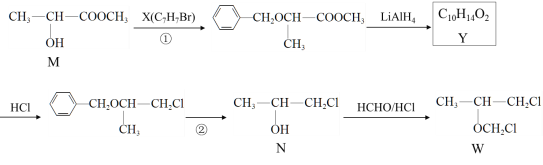
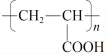 )的合成路线_______________________ 。
)的合成路线_______________________ 。