-
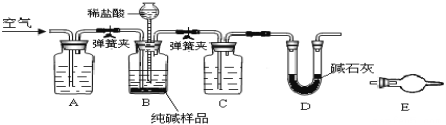
现有下列三个氧化还原反应:
①2FeCl3+2KI=2FeCl2+2KCl+I2 ②2FeCl2+Cl2=2FeCl3
③2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
若某溶液中含有Fe2+、Cl-和I-,要除去I-而不氧化Fe2+和Cl-,可以加入的试剂是( )
A. Cl2 B. KMnO4 C. FeCl3 D. HCl
难度: 中等查看答案及解析
-
完成下列实验所需选择的装置或仪器都正确的是( )
A
B
C
D
实验
分离植物油
和NaCl溶液
除去NaCl晶体中混有的
NH4Cl晶体
分离CCl4中
的Br2
除去CO2中
的HCl气体
装置
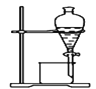
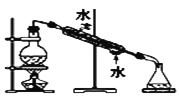
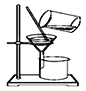
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列关于N2和CO的叙述正确的是 ( )
A. 28g两者混合物含有2mol原子 B. 同温度、同压的N2和CO密度之比为1:2
C. 同温度、同体积时两者质量相等 D. 同压强、同体积时两者分子数相等
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A. 10mL质量分数为98%的H2SO4,用10mL水稀释后,H2SO4的质量分数等于49%
B. 配制0.1mol/L的Na2CO3溶液190mL,需用200mL容量瓶
C. 将40克NaOH溶于1L水中,得到1mol/L的溶液
D. 常温常压下11.2LCl2含原子数小于NA
难度: 简单查看答案及解析
-
下列与化学概念有关的说法正确的是( )
A. Na2O2、CaO、Fe2O3均为碱性氧化物
B. 碱性氧化物一定是金属氧化物
C. 非金属氧化物一定是酸性氧化物
D. 和碱反应生成盐和水的氧化物是酸性氧化物
难度: 简单查看答案及解析
-
下列关于胶体的叙述中,正确的是( )
A. 丁达尔效应是分散系分类的本质特征,可区分溶液和胶体
B. 胶体能透过半透膜,但不能透过滤纸
C. 胶体的电泳实验说明了胶体带有电荷
D. “江河入海口三角洲的形成”和“伤口上撒盐”通常与胶体的聚沉有关
难度: 简单查看答案及解析
-
在无色透明的酸性溶液中,能大量共存的离子组是 ( )
A. NH4+ NO3- Al3+ Cl- B. K+ SO42- HCO3- Na+
C. Ca2+ NO3- CH3COO- Na+ D. Cu2+ K+ SO42- Na+
难度: 简单查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A. 铜与盐酸反应:Cu+2H+=Cu2++H2↑
B. 碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑
C. 硝酸银溶液与铜粉反应:2Ag++Cu=Cu2++2Ag
D. 稀H2SO4与Ba(OH)2溶液反应:Ba2++SO42-=BaSO4↓
难度: 简单查看答案及解析
-
8NH3+6NO2=7N2+12H2O,若还原产物比氧化产物少0.1 mol,下列正确的是( )
A. 转移电子4.8NA个 B. 生成气体的体积15.68 L
C. 还原剂比氧化剂多0.2 mol D. 被还原的氮原子是ll.2 g
难度: 简单查看答案及解析
-
用11.92gNaClO与0.01mol Na2Sx恰好完全反应,生成Na2SO4和NaCl,则x数值为( )
A. 3 B. 4 C. 5 D. 6
难度: 简单查看答案及解析
-
下列有关物质性质与用途具有对应关系的是( )
A. NaHCO3受热易分解,可用于制胃酸中和剂
B. FeCl3有氧化性,可用于制净水剂
C. Al2O3是两性氧化物,可用作耐高温材料
D. CaO能与水反应,可用作食品干燥剂
难度: 简单查看答案及解析
-
下列各组物质,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是( )
A. AlCl3和NaOH B. H2SO4和Ba(OH)2 C. NaAlO2和H2SO4 D. Na2CO3和HCl
难度: 简单查看答案及解析
-
标况下4.48LCO2与一定量Na2O2反应后收集到3.36L气体,则这3.36L气体的质量是( )
A. 3.8g B. 5.6g C. 4.8g D. 6.0g
难度: 简单查看答案及解析
-
120 mL含有0.20 mol碳酸钠的溶液和200 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸浓度合理的是( )
A. 2.0mol/L B. 0.24mol/L C. 0.18 mol/L D. 1.5 mol/L
难度: 简单查看答案及解析
-
一定量钠铝合金置于水中,合金全部溶解得到200 mL c(OH-)=0.1mol/L的溶液,然后逐滴加入1mol/L盐酸测得生成沉淀质量m与消耗盐酸体积V关系如图,下列正确的是( )
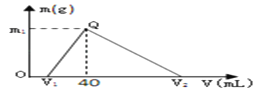
A. 原合金质量为0.92g
B. Q点m1为1.56g
C. 整个加入盐酸过程中Na+的浓度保持不变
D. 图中V2为60mL
难度: 中等查看答案及解析
-
Fe2O3和铁粉的混合物中加入适量稀H2SO4,各物质恰好完全反应,测得溶液中不含Fe3+,且Fe2+与H2物质的量之比为4:1,那么在反应中Fe2O3、Fe、H2SO4的物质的量之比为( )
A. 1:1:1 B. 1:2:3 C. 1:2:4 D. 2:3:5
难度: 中等查看答案及解析