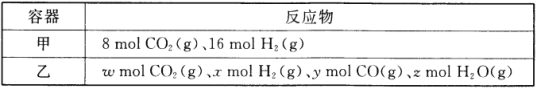-
硫代硫酸钠(Na2S2O3)在生产生活中具有广泛应用。回答下列问题:
I.工业上普遍使用Na2SO3与硫磺共煮制备Na2S2O3,装置如图1。
(1)打开K1关闭K2,向圆底烧瓶中加入足量试剂甲并加热。试剂甲为_________,装置B和D的作用是_________。
(2)始终保持C中溶液呈碱性、加热产生Na2S2O3,反应的化学方程式为___________________________。反应一段时间后,C中硫粉逐渐减少,及时打开K2、关闭K1并停止加热,将C中所得混合物分离提纯后即得到Na2S2O3。若不及时关闭K1,将导致C中溶液呈酸性、发生副反应产生S和_________。
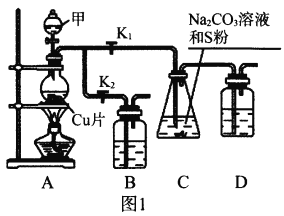
Ⅱ.利用SO2与Na2CO3、Na2S的混合溶液反应也能制备Na2S2O3,所需仪器如图2。
(1)装置G中Na2CO3与Na2S的最佳物质的量之比为_________。
(2)从左到右连接各仪器,接口顺序为:_________接g、h接_________、_________接_________、_________接d。
Ⅲ.常用Na2S2O3溶液测定废水中Ba2+浓度。
取废水20.00mL,控制适当的酸度加入足量K2Cr2O7溶液,得 BaCrO4沉淀;过滤洗涤后用适量稀酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,将Cr2O72-充分反应:Cr2O72-+6I-+14H+=3I2+2Cr3++7H2O。然后加入淀粉溶液作指示剂,用0.0100mol/L的Na2S2O3溶液进行滴定:I2+2S2O32-===S4O62-+2I-。当溶液_________即为终点。平行滴定3次,消耗Na2S2O3溶液的平均用量为18.00m,则该废水中Ba2+的物质的量浓度为_________。
-
氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下
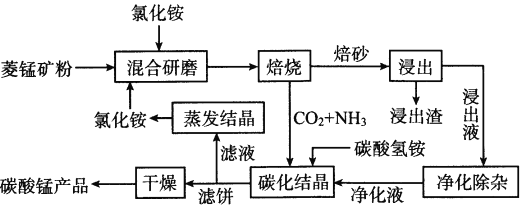
已知:①菱锰矿的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②相关金属离子[c0(Mn+)=0.1mol/L形成氢氧化物沉淀的pH范围如下:
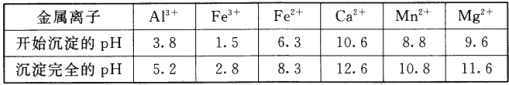
③常温下,CaF2、MgF2的溶度积分别为1.46×10-10、7.42×10-11。
回答下列问题:
(1)“焙烧”时发生的主要反应的化学方程式为__________________。
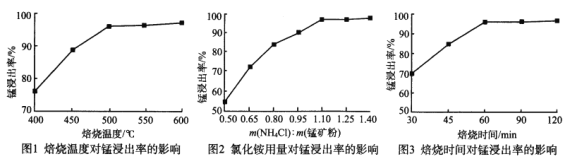
分析下列图1、图2、图3,氯化铵焙烧菱锰矿的最佳条件是:焙烧温度为_________、氯化铵与锰矿粉的质量之比为_________、焙烧时间为_________。
(2)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式为_________;再调节溶液的pH将Al3+、Fe3+变为沉淀除去,溶液pH的范围为_________;然后加入NH4F将Ca2+、Mg2+变为CaF2、MgF2沉淀除去,两种沉淀共存时溶液中c(Ca2+)/c(Mg2+)=_________。
(3)碳化结晶时,反应的离子方程式为__________________。
(4)将制得的高纯度碳酸锰溶于过量稀硫酸后用惰性电极电解,在某极得到重要的无机功能材料MnO2,该电极的电极反应式为__________________。
-
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。回答下列问题:
I.CO可用于高炉炼铁,已知
Fe3O4(s)+4CO(g)====3Fe(s)+4CO2(g) △H1 =a kJ/ mol
3Fe2O3(s)+CO(g)====2Fe3O4 (s)+CO2(g) △H2=bkJ/mol
则反应Fe2O3(s)+3CO(g)====2Fe(s)+3CO2(g)的△H3=_________kJ/mol(用含a、b的代数式表示)
Ⅱ.一定条件下,CO2和CO可以互相转化。
(1)某温度下,在容积为2L的密闭容器按甲、乙两种方式投入反应物发生反应:CO2(g)+H2(g)  CO(g)+H2O(g)。
CO(g)+H2O(g)。
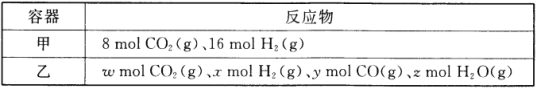
甲容器15min后达到平衡,此时CO2的转化率为75%。则0~15min内平均反应速率v(H2)= _________,此条件下该反应的平衡常数K=_________。
欲使平衡后乙与甲中相同组分气体的体积分数相等,则ω、x、y、z需满足的关系是_________,且_________ (用含y的等式表示)。
(2)研究表明,温度、压强对反应“C6H5CH2CH3(g)+CO2(g)  C6H5CH=CH2(g)+CO(g)+H2O(g) △H”中乙苯的平衡转化率影响如下图所示:
C6H5CH=CH2(g)+CO(g)+H2O(g) △H”中乙苯的平衡转化率影响如下图所示:
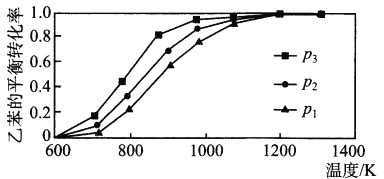
则△H_________ 0(填“>”“<”或“=”),压强p1、p 2、p3从大到小的顺序是_________。
(3)CO可被NO2氧化:CO+NO2 CO2+NO。当温度高于225℃时,反应速率v正=k正·c(CO)·c(NO2)、v逆=k逆·c(CO2)·c(NO),k正、k逆分别为正、逆反应速率常数。在上述温度范围内,k正、k逆与该反应的平衡常数K之间的关系为_________。
CO2+NO。当温度高于225℃时,反应速率v正=k正·c(CO)·c(NO2)、v逆=k逆·c(CO2)·c(NO),k正、k逆分别为正、逆反应速率常数。在上述温度范围内,k正、k逆与该反应的平衡常数K之间的关系为_________。
-
铁、钴、镍具有相似的性质,在化学上称为铁系元素。回答下列问题:
(1)LiCoO2、 LiFePO4常用作锂离子电池的正极材料。基态Co原子核外电子排布式为_________,第四电离能I4(Co) _________I4(Fe)(填“>”或“<”),PO43-的空间构型为_________。
(2)铁系元素能与CO形成Fe(CO)5、Ni(CO)4等金属羰基配合物。
与CO互为等电子体的分子和离子分别为_________和_________(各举一种,填化学式);在CO分子中,键与π键数目之比为_________。
(3)铁与K2O、 (环戊二烯)在隔绝空气条件下共热可制得二茂铁[Fe(C5H5)2]。在环戊二烯中,C原子的杂化轨道类型为_________。二茂铁熔点为446K,不溶于水,易溶于乙醚、苯、乙醇等有机溶剂,373K即升华;从各种性质看,都表明它是典型的_________化合物。
(环戊二烯)在隔绝空气条件下共热可制得二茂铁[Fe(C5H5)2]。在环戊二烯中,C原子的杂化轨道类型为_________。二茂铁熔点为446K,不溶于水,易溶于乙醚、苯、乙醇等有机溶剂,373K即升华;从各种性质看,都表明它是典型的_________化合物。
(4)铁单质的堆积方式有两种,其剖面图分别如图a、b所示。

在图a所示堆积方式里铁原子的半径为rpm,则其晶胞棱长为_________cm。
在图b所示堆积方式里铁原子的总体积占晶体体积的比例为_________(用含圆周率π的代数式表示)
-
盐酸利多卡因(F)可用于急性心肌梗塞后室性早搏和室性心动过速,合成路线如下:
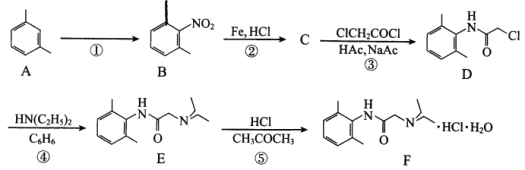
回答下列问题:
(1)A的化学名称为_________。
(2)反应①所需试剂、条件分别为_________、_________。
(3)B的同分异构体种类很多,符合以下条件的B的同分异构体共有_________种(不考虑立体异构)、其中官能团的名称是_________。
①属于苯的衍生物,苯环上共有三个取代基;
②与碳酸氢钠溶液反应可放出CO2气体。
(4)C的结构简式为_________。
(5)在反应①~⑤中属于取代反应的有_________。
(6)ClCH2COCl与足量NaOH溶液共热充分反应的化学方程式为_________。
(7)NH(C2H5)2在核磁共振氢谱上有_________组峰,峰面积比为_________。
 ,下列关于半胱氨酸说法不正确的是
,下列关于半胱氨酸说法不正确的是(高半胱氨酸)互为同系物
AlLi+Cx PF6下列有关该电池的说法正确的是
或
]随pH的变化关系如图所示。下列说法不正确的是