-
下列各组离子中,能在溶液中大量共存的是( )
A. Na+、Cu2+、Cl﹣、OH﹣ B. H+、Ca2+、HCO3﹣、NO3﹣
C. Fe2+、H+、SO42﹣、NO3﹣ D. Na+、CO32﹣、OH﹣、K+
难度: 中等查看答案及解析
-
下列说法正确的个数有
①盐卤点豆腐、江河入海口处“三角洲”的形成、高压直流电除烟尘均与胶体的性质有关
②通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动
③氢氧化铁胶体能稳定存在的主要原因是胶体粒子做布朗运动
④做氢氧化铁胶体电泳实验时,阴极周围红褐色加深,说明氢氧化铁胶体带正电
⑤向FeCl3溶液中滴加NaOH溶液,可制得Fe(OH)3胶体
⑥1mol FeCl3完全与水反应生成氢氧化铁胶体粒子数约为NA个
⑦淀粉溶液和蛋白质溶液是溶液,不可能是胶体
A. 1个 B. 2个 C. 3个 D. 4个
难度: 中等查看答案及解析
-
今有一种固体化合物X,X本身不导电,但熔化状态或溶于水中能够电离,下列关于该化合物X的说法中正确的是
A. X一定是电解质 B. X可能为非电解质
C. X只能是盐类 D. X可以是任意化合物
难度: 简单查看答案及解析
-
对于易燃、易爆、有毒的化学物质,往往会在其包装上面贴上危险警告标签。下列物质贴错了包装标签的是( )
A. 浓硫酸
 B. 汽油
B. 汽油  C. 酒精
C. 酒精  D. 氯化钾
D. 氯化钾
难度: 中等查看答案及解析
-
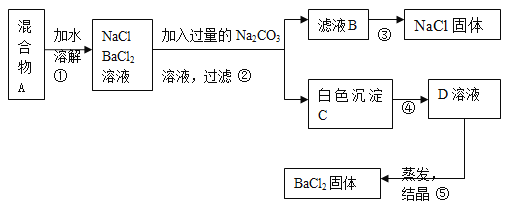
完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是
选项
A
B
C
D
实验
用CCl4提取溴水中的Br2
除去乙醇中的苯
从KI和I2的固体混合物中回收I2
配制100 mL 0.1000mol·L−1 K2Cr2O7溶液
装置或仪器
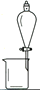
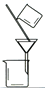

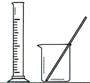
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸的反应为:S+2KNO3+3C
K2S+N2↑+3CO2↑,下列说法中正确的是 ( )
A. 该反应中的还原剂为KNO3
B. 该反应中C被还原
C. 若消耗32g S,该反应转移电子数为2 NA
D. 若生成标准状况下气体22.4L,则有0.75 mol物质被还原
难度: 中等查看答案及解析
-
阿伏加德罗常数的值为NA,下列说法中正确的是( )
A. 5NH4NO3
2HNO3+4N2↑+9H2O反应中,生成28 g N2,转移的电子数目为3.75NA
B. 常温常压下,ag某气体含分子数为b,则cg该气体的体积为
C. 2mol/L的CaCl2溶液中Cl-的数目为4NA
D. 46g NO2和N2O4的混合气体中含有的氧原子个数为3NA
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 摩尔是一种国际基本物理量
B. 氧气的摩尔质量为32g
C. H2的气体摩尔体积约为22.4L
D. 1mol H2O约含有6.02×1023个水分子
难度: 简单查看答案及解析
-
氧化还原反应与四种基本反应类型的关系如下所示,则下列化学反应属于阴影部分的是( )
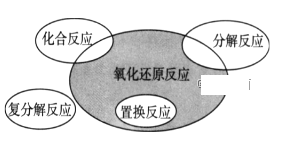
A.
B.
C.
D.
难度: 简单查看答案及解析
-
下列离子方程式正确的是( )
A. 往NaHSO4溶液中加Ba(OH)2溶液至恰好中和:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
B. 碳酸钙与盐酸反应:2H++CO32-=CO2↑+H2O
C. 铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
D. 往Ba(OH)2溶液中加少量硫酸溶液:Ba2++OH-+H++SO42-=BaSO4↓+H2O
难度: 简单查看答案及解析
-
下列溶液中,溶质的物质的量浓度不是1 mol·L-1的是( )
A. 10g NaOH固体溶解在水中配成250mL溶液
B. 将80g SO3溶于水并配成1L的溶液
C. 将0.5mol·L-1的NaNO3溶液100mL加热蒸发掉50g水的溶液
D. 标况下,将22.4L氯化氢气体溶于水配成1L溶液
难度: 简单查看答案及解析
-
将SO2通入足量Fe2(SO4)3溶液中,完全反应后再加入K2CrO4溶液,发生的两个化学反应为SO2+2Fe3++2H2O=SO42-+2Fe2++W ①,Cr2O72-+aFe2++bH+
Cr3++Fe3++H2O ②,下列有关说法正确的是
A. 还原性:Cr3+>SO2 B. 配平后方程式②中,a=6,b=7
C. Cr2O72-能将Na2SO3氧化成Na2SO4 D. 方程式①中W为OH-
难度: 中等查看答案及解析
-
200 mL 0.3 mol/L的K2SO4溶液和100 mL 0.2 mol/L的Fe2(SO4)3溶液混合后(不考虑混合后溶液体积的变化),溶液中SO42-的物质的量浓度为
A. 0.3 mol/L B. 0.4 mol/L C. 0.45 mol/L D. 0.5 mol/L
难度: 中等查看答案及解析
-
下列离子方程式的书写中,正确的是
A. H2SO4与Ba(OH)2溶液反应: Ba2++ OH- + H+十SO42-= BaSO4↓ + H2O
B. 碳酸钙中加入盐酸 : CO32- + 2H+ = CO2↑ + H2O
C. 将氢氧化铁放入盐酸中: Fe(OH)3 + 3H+ = Fe3+ + 3H2O
D. 氧化铜与稀硫酸反应: 2H+ + O2—= H2O
难度: 中等查看答案及解析
-
物质的量浓度为0.05 mol·L-1的金属氯化物(RClx) 溶液20 mL,恰好与20 mL 0.15 mol·L-1的AgNO3溶液完全反应。则x为
A. 1 B. 2 C. 3 D. 4
难度: 中等查看答案及解析
-
常温常压下,用等质量的CH4、CO2、O2、SO2四种气体分别吹出四个气球,其中气体为CH4的是( )。
A.
B.
C.
D.
难度: 简单查看答案及解析