-
下列物质中含有非极性键且为盐的是( )
A. CH3COONa B. NH4Cl C. CaCl2 D. H2O2
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 同一周期相邻主族的两种元素的原子序数之差是1
B. 同一主族的两种元素的原子序数之差不可能是36
C. 同一主族相邻周期的两种元素的原子序数之差可能是18
D. 同一主族相邻周期的两种元素的原子序数之差都相同
难度: 中等查看答案及解析
-
在硼酸[B(OH)3]分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构。则分子中B原子杂化轨道的类型及同层分子间的主要作用力分别是
A. sp,范德华力 B. sp2,范德华力
C. sp2,氢键 D. sp3,氢键
难度: 中等查看答案及解析
-
第N能层所含能级数、原子轨道数和最多容纳电子数分别为
A. 3、9、18 B. 4、12、24
C. 5、16、32 D. 4、16、32
难度: 简单查看答案及解析
-
最近,美国普度大学的研究人员开发出一种利用铝镓合金加水制造氢气的新工艺。这项技术具有广泛的能源潜在用途,包括为汽车提供原料、为潜水艇提供燃料等。该技术通过向铝镓合金注水,铝生成氧化铝,同时生成氢气。合金中镓(Ga,ⅢA)是关键成分,可阻止铝形成致密的氧化膜。下列关于铝、镓的说法正确的是
A. 铝的金属性比镓强
B. 铝的熔点比镓低
C. Ga(OH)3与Al(OH)3性质相似,一定能与NaOH溶液反应
D. 铝、镓合金与水反应后的物质可以回收利用冶炼铝
难度: 简单查看答案及解析
-
下列不是配合物的是( )
A. [Ag(NH3)2]Cl B. Cu2(OH)2CO3
C. [Cu(H2O)4]SO4 D. Co(NH3)6Cl3
难度: 中等查看答案及解析
-
下列物质中,属于含有极性共价键的离子晶体的是
A. CsCl B. KOH C. H2O D. Na2O2
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. s电子云是在空间各个方向上伸展程度相同的对称形状
B. p电子云是平面“8”字形的
C. 2p能级有一个未成对电子的基态原子的电子排布式一定为1s22s22p5
D. 2d能级包含5个原子轨道,最多容纳10个电子
难度: 简单查看答案及解析
-
下列分子中的中心原子杂化轨道的类型和分子构型都相同的是
A. CO2与SO2 B. NH3与BF3
C. CH4与NH4+ D. C2H2与C2H4
难度: 中等查看答案及解析
-
在短周期主族元素中,原子的核电荷数、核外电子层数、每层所容纳的电子数、主族序数均为偶数的有
A. 2种 B. 3种 C. 4种 D. 8种
难度: 中等查看答案及解析
-
表示一个原子在第三个能层上有10个电子可以写成
A. 3s10 B. 3d10 C. 3s23p63d2 D. 3s23p53d3
难度: 简单查看答案及解析
-
下列四种粒子中,半径按由大到小排列顺序正确的是
①基态X的原子结构示意图

②基态Y的价电子排布式:3s23p5
③基态Z2-的电子排布图

④W基态原子有2个能层,电子式为
A. ①>②>③>④ B. ③>④>①>②
C. ③>①>②>④ D. ①>②>④>③
难度: 中等查看答案及解析
-
对原子核外的电子运动描述方法正确的是
A. 根据一定的数据计算出它们某一时刻所在的位置
B. 用一定仪器测定或描述出它们的运动轨道
C. 核外电子的运动有确定的轨道
D. 核外电子的运动根本不具有宏观物体运动规律,只能用统计规律来描述
难度: 简单查看答案及解析
-
下列说法中错误的是
A. 所有的非金属元素都分布在p区
B. 元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
C. 除氦以外的稀有气体原子的最外层电子数都是8
D. 3p能级上只有一个空轨道的原子和3p能级上只有一个未成对电子的原子,两原子对应的元素属于同一周期
难度: 简单查看答案及解析
-
下表列出了某短周期元素R的各级电离能数据(用I1、I2……表示,单位为kJ·mol-1)。下列关于元素R的判断中一定正确的是

①R的最高正价为+3价
②R元素位于元素周期表中第ⅡA族
③R元素第一电离能大于同周期相邻元素
④R元素基态原子的电子排布式为1s22s2
A. ①② B. ②③ C. ③④ D. ①④
难度: 中等查看答案及解析
-
若将15P原子的电子排布式写成1s22s22p63s23p
3p
,它违背了
A. 能量守恒原理 B. 泡利原理
C. 能量最低原理 D. 洪特规则
难度: 中等查看答案及解析
-
已知[ZnCl4]2-中Zn2+的4s轨道和4p轨道形成sp3型杂化轨道,则[ZnCl4]2-的空间构型为
A. 直线形 B. 平面三角形
C. 平面正方形 D. 正四面体形
难度: 简单查看答案及解析
-
固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外层电子结构,则下列有关说法中不正确的是
A. 1 mol NH5中含有5NA个N—H键(NA表示阿伏加德罗常数)
B. NH5中既有共价键又有离子键,它形成的晶体是离子晶体
C. NH5的电子式为
D. 它与水反应的化学方程式为:NH5+H2O===NH3·H2O+H2↑
难度: 中等查看答案及解析
-
对三硫化四磷分子的结构研究表明,该分子中没有不饱和键,且各原子的最外层均已达到了8个电子的结构。则一个三硫化四磷分子中含有的共价键个数是
A. 7个 B. 9个 C. 19个 D. 不能确定
难度: 中等查看答案及解析
-
下列说法中,错误的是
A. 非金属元素可能形成离子化合物
B. 成键原子间原子轨道重叠的愈多,共价键愈牢固
C. 对双原子分子来说,键能愈大,含有该键的分子愈稳定
D. 键长愈长,化学键愈牢固
难度: 简单查看答案及解析
-
能说明CH4分子的5个原子不在同一平面而为正四面体构型的是
A. 两个键之间夹角为109.5° B. C—H键为极性共价键
C. 4个C—H键的键能、键长相同 D. 碳的价层电子都形成共价键
难度: 中等查看答案及解析
-
如图所示的是某原子晶体A空间结构的一个单元,A与某物质B反应生成C,其实质是每个A﹣A键中插入一个B原子,则C物质的化学式为

A. AB B. A5B4 C. AB2 D. A2B5
难度: 中等查看答案及解析
-
下列说法正确的是
A. Na2O2晶体中,阴、阳离子个数比是1∶1
B. NaCl晶胞中有1个Na+和1个Cl-
C. CaF2晶体中,Ca2+和F-的配位数之比为1∶2
D. CsCl晶胞中,Cl-的配位数是8
难度: 简单查看答案及解析
-
金属的下列性质中,不能用金属的电子气理论加以解释的是
A. 易导电 B. 易导热 C. 易腐蚀 D. 有延展性
难度: 简单查看答案及解析
-
表中原子化热、晶格能、键能的单位都是kJ•mol﹣1

则下列说法正确的是
A. Na(s)与Cl2(g)反应生成1mol NaCl(s)放出的热量为556.1kJ
B. Si(s)+2Cl2(g)═SiCl4(g)△H=﹣602kJ•mol﹣1
C. 从表中可以看出,氯化钠的熔点比晶体硅高
D. 从表中数据可以看出,微粒半径越大金属键、离子键越弱,而共价键却越强
难度: 中等查看答案及解析
-
关于如图叙述不正确的是
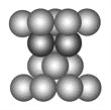
A. 该种堆积方式为A3型最密堆积
B. 该种堆积方式称为A1型最密堆积
C. 该种堆积方式可用符号“…ABCABC…”表示
D. 金属Cu就属于此种最密堆积型式
难度: 简单查看答案及解析
-
已知食盐的密度为ρ g·cm-3,其摩尔质量为M g·mol-1,阿伏加德罗常数为NA,则在食盐晶体里Na+和Cl-的间距大约是
A.
cm B.
cm C.
cm D.
cm
难度: 中等查看答案及解析
-
关于金属元素的特征,下列叙述正确的是
①金属元素的原子只有还原性,离子只有氧化性 ②金属元素在化合物中一般显正价 ③金属性越强的元素相应的离子氧化性越弱 ④金属元素只有金属性,没有非金属性⑤价电子数越多的金属原子的金属性越强
A. ①②③ B. ②③ C. ①⑤ D. ①②③④⑤
难度: 中等查看答案及解析