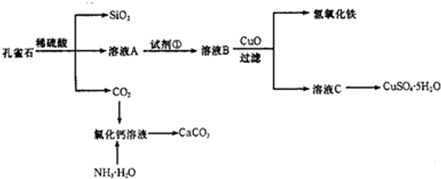
-
向体积为Va的0.05mol•L-1CH3COOH溶液中加入体积为Vb的0.05mol•L-1KOH溶液,下列关系错误的是( )
A.Va>Vb时:c(CH3COOH)+c(CH3COO-)>c(K+)
B.Va=Vb时:c(CH3COOH)+c(H+)=c(OH-)
C.Va<Vb时:c(CH3COO-)>c(K+)>c(OH-)>c(H+)
D.Va与Vb任意比时:c(K+)+c(H+)=c(OH-)+c(CH3COO-)难度: 中等查看答案及解析
-
简单原子或离子的结构可用下图形象地表示:
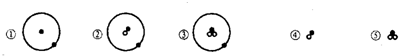
其中“●”表示质子或电子,“O”表示中子,则下列有关上述微粒的叙述正确的是( )
A.②和④、③和⑤互为同素异形体
B.①和③互为同位素
C.②和④是两种化学性质相同的粒子
D.①和④、②和⑤具有相同的质量数难度: 中等查看答案及解析
-
下列叙述中错误的是( )
A.电解池的阳极上发生氧化反应,阴极上发生还原反应
B.原电池跟电解池连接后,电子从电池负极流向电解池阳极
C.电镀时,电镀池里的阳极材料发生氧化反应
D.电解饱和食盐水时,阴极得到氢氧化钠溶液和氢气难度: 中等查看答案及解析
-
为达到预期的实验目的,下列操作正确的是( )
A.欲配制质量分数为10%的ZnS04溶液,将10gZnS04•7H20溶解在90g水中
B.欲制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸
C.为鉴别KCl、AlCl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量
D.为减小中和滴定误差,锥形瓶必须洗净并烘干后才能使用难度: 中等查看答案及解析
-
下列指定溶液中的各组离子能够大量共存的是( )
A.pH=11的溶液中:S2-、K+、、Cl-
B.无色溶液中:Fe3+、、
、K+
C.pH=1的溶液中:Fe2+、、Mg2+、
D.水电离的c(H+)=10-12mol•L-1的溶液中:Ca2+、Na+、Cl-、难度: 中等查看答案及解析
-
温度、催化剂不变,向某一固定体积的密闭容器中按下列各物质的量加入H2、N2、NH3,反应达平衡时,氨气浓度最大的一组是( )
A B C D H2 6 1 3.5 5 N2 2 1 1.5 NH3 4 2 1
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
下列用来表示物质变化的化学用语中,正确的是( )
A.次氯酸钙溶液中通入过量的SO2:ClO-+H2O+SO2=+HClO
B.钢铁发生电化学腐蚀的正极反应:4OH--4e-═2H2O+O2↑
C.的水【解析】
+H2O⇌
+H3O+
D.甲烷碱性燃料电池的负极反应:CH4+100H--8e-═+7H2O
难度: 中等查看答案及解析
-
在一定条件下KI、Zn、FeBr2分别与足量的Cl2反应,如果3个反应得失电子数目相等,则KI、Zn、FeBr2的物质的量之比为( )
A.1:2:3
B.3:2:1
C.6:3:2
D.2:3:6难度: 中等查看答案及解析