-
下列各组混合物中,能用分液漏斗进行分离的是
A. 醋酸和水 B. 水和四氯化碳 C. 碘和四氯化碳 D. 汽油和植物油
难度: 简单查看答案及解析
-
关于同温同压下等体积的CO2和CO的叙述:①质量相等②密度相等③所含分子数相等④所含碳原子数相等,其中正确的是
A. ①②③④ B. ②③④ C. ③④ D. ③
难度: 简单查看答案及解析
-
下列物质与危险化学品标志的对应关系不正确的是
A
B
C
D
酒精
氢气
浓硫酸
氢氧化钠




A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列有关实验室一般事故的预防和处理方法不正确的是
A. 燃着的酒精灯打翻失火,应立即湿抹布盖灭
B. 不慎将酸溅到眼中,立即用大量流动的水冲洗,边洗边眨眼
C. 用滴管滴加液体时,滴管下端紧贴试管内壁
D. 稀释浓硫酸时,将浓硫酸缓缓加入盛水的烧杯中并用玻璃棒不断搅拌溶液
难度: 简单查看答案及解析
-
下列化学式书写不正确的是
A. 干冰CO2 B. 硝酸HNO3 C. 硫酸银Ag2SO4 D. 纯碱NaOH
难度: 简单查看答案及解析
-
下列物质中,属于纯净物的是
A. 浓硫酸 B. 碘酒 C. 液氨 D. 84消毒液
难度: 简单查看答案及解析
-
在盛有碘水的试管中,加入少量CCl4后振荡,静置片刻后的正确现象是
A. 溶液分层,上层紫红色 B. 溶液分层,下层紫红色
C. 整个溶液变为棕黄色 D. 整个溶液变紫红色
难度: 简单查看答案及解析
-
可将碘水中的碘萃取出来的萃取剂应具备的性质是
A. 不溶于水,比水密度大 B. 不溶于水,比水密度小
C. 不溶于水,易与碘发生化学反应 D. 不溶于水,比水更易使碘溶解
难度: 简单查看答案及解析
-
四个实验:①配制一定物质的量浓度的溶液 ②pH试纸的使用 ③过滤 ④蒸发。以上实验中均需要用到的仪器是
A. 玻璃棒 B. 试管 C. 胶头滴管 D. 漏斗
难度: 简单查看答案及解析
-
下列各组固体物质可按溶解、过滤、蒸发的操作顺序,将它们分离的是
A. KCl和AgNO3 B. Na2SO4和BaSO4
C. KNO3和NH4Cl D. C粉和CuO
难度: 简单查看答案及解析
-
下列实验操作不正确的是
A. 分液时,上层液体上口出,下层液体下口出
B. 当蒸发到剩有少量液体时停止加热,利用余热将液体蒸干
C. 给蒸馏烧瓶中液体加热时需要加入沸石,防暴沸
D. 过滤时用玻璃棒搅拌漏斗内的待过滤的液体,加快过滤速度
难度: 简单查看答案及解析
-
已知丙酮通常是无色液体,不溶于水,密度小于1g/cm3,沸点约为55℃。要从水与丙酮的混合物里将丙酮分离出来,下列方法中最合理的是
A. 分液 B. 蒸发 C. 过滤 D. 蒸馏
难度: 简单查看答案及解析
-
实验过程中,下列溶液的导电能力变化不大的是
A. 醋酸溶液中滴入氨水至过量
B. Ba(OH)2溶液中滴入H2SO4溶液至过量
C. 澄清石灰水中通入CO2至过量
D. NH4Cl溶液中加入NaOH固体至恰好反应
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数,下列说法中正确的是
A. 1 mol/L的NaCl中所含Na+数目为NA
B. 22.4LCl2所含的分子数目为NA
C. 32g O2所含的原子数目为2NA
D. 56g铁与足量盐酸反应转移的电子数为3NA
难度: 简单查看答案及解析
-
下列说法中正确的是
A. O2的相对分子质量为32 g B. 1 mol CO2的质量为44g/mol
C. 1mol OH-的质量等于17 D. H2O的摩尔质量为18g/mol
难度: 简单查看答案及解析
-
下列有关气体体积的叙述中,正确的是
A. 不同的气体,若体积不同,则它们所含的分子数也不同
B. 一定温度和压强下,气体体积由构成气体的分子数决定
C. 一定温度和压强下,气体体积由构成气体的分子大小决定
D. 气体摩尔体积是指1 mol任何气体所占的体积约为22.4 L
难度: 中等查看答案及解析
-
下列关于1 mol·L-1碳酸钠溶液的说法中,不正确的是
A. 1mol Na2CO3溶于1 L水中
B. 1 L溶液中含有106 g Na2CO3
C. 1 L溶液中含有1mol Na2CO3
D. 106g Na2CO3溶于少量水后,再加水稀释至1000 mL
难度: 简单查看答案及解析
-
下列溶液的Cl浓度与75mL 1mol/L MgCl2溶液中的Cl-浓度相等的是
A. 150mL 1mol/L的NaCl B. 75mL 1mol/L的AlCl3
C. 25mL 3mol/L的KCl D. 100mL 1mol/L的CaCl2
难度: 简单查看答案及解析
-
下列关于胶体的叙述中,不正确的是
A. 用半透膜除去淀粉胶体中的NaCl B. 胶体中分散质粒子的直径小于1nm
C. 丁达尔效应可以区分溶液和胶体 D. 胶体粒子可以透过滤纸
难度: 简单查看答案及解析
-
在溶液中,下列电离方程式不正确的是
A. Ba(OH)2=Ba2++2OH- B. NaHSO4=Na++H++SO42-
C. NaHCO3=Na++HCO3- D. H2SO4=H2++SO42-
难度: 简单查看答案及解析
-
下列关于酸性氧化物的说法中,肯定不正确的是
A. 酸性氧化物都能与水反应生成酸 B. 酸性氧化物可与碱反应生成盐和水
C. 酸性氧化物不一定是非金属氧化物 D. 非金属氧化物不一定是酸性氧化物
难度: 中等查看答案及解析
-
下列离子方程式改写成化学方程式正确的是
A. Mg2++2OH-=Mg(OH)2↓ MgCO3+2Ba(OH)2=Mg(OH)2↓+BaCO3
B.
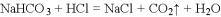
C.
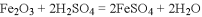
D.

难度: 中等查看答案及解析
-
一种试剂与AgNO3溶液、KNO3溶液、K2CO3溶液混合,现象均不相同的是
A. 稀HNO3 B. BaCl2溶液 C. 稀盐酸 D. NaOH溶液
难度: 简单查看答案及解析
-
为了除去粗盐中Ca2+、Mg2+、SO42-及少量泥沙,可将粗盐溶于水,然后进行下列五项操作。 ①加过量Na2CO3溶液 ②加过量的NaOH溶液 ③加适量盐酸 ④加过量BaCl2溶液 ⑤过滤 其中操作顺序正确的是
A. ①④②③⑤ B. ②④⑤①③ C. ④①②⑤③ D. ⑤②④①③
难度: 中等查看答案及解析
-
在某无色透明的酸性溶液中,能大量共存的离子组是
A. K+、Ba2+、Cl-、SO42- B. Na+、NH4+、Cl-、NO3-
C. NH4+、Fe3+、SO42-、NO3- D. K+、HCO3-、Cl-、OH-
难度: 中等查看答案及解析
-
下列说法正确的是
A. 盐酸既有氧化性,又有还原性
B. 阳离子只有氧化性,阴离子只有还原性
C. 氧化剂在反应中被氧化,还原剂在反应中被还原
D. 在氧化还原反应中,氧化剂与还原剂不可能是同一种物质
难度: 简单查看答案及解析
-
下列物质常用作氧化剂的是
A. CO B. Al C. FeCl3 D. H2
难度: 简单查看答案及解析
-
下列化学变化中,不需要另外加入氧化剂就可以实现的是
A. H2O2→O2 B. KI→I2 C. Cu→CuO D. CH4→CO2
难度: 中等查看答案及解析
-
实验室中可用如下反应制取氯气:K2Cr2O7+14HCl(浓)=2KCl+2CrCl3+3Cl2↑+H2O,此反应中被氧化与被还原的原子个数比为
A. 1:3 B. 3:1 C. 14:1 D. 6:1
难度: 中等查看答案及解析
-
60 mL 0.5mol/L Na2SO3溶液恰好与40mL 0.3mol/L KMnO4溶液完全反应,则元素Mn在还原产物中的化合价为
A. +2 B. +4 C. +6 D. +7
难度: 中等查看答案及解析