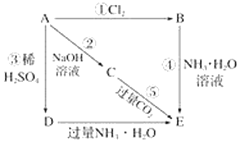
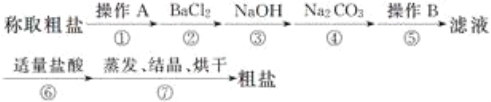
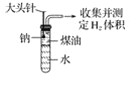
-
下列说法正确的是
①正常雨水的pH为7.0,酸雨的pH小于7.0
②严格执行机动车尾气排放标准有利于防止大气污染
③使用二氧化硫和某些含硫化合物进行增白的食品会对人体健康产生损害
④使用氯气对自来水消毒过程中,生成的有机氯化物可能对人体有害
⑤食品厂产生的含丰富氮、磷营养元素的废水可长期排向水库养鱼
A. ①②③ B. ①④⑤ C. ②③④ D. ③④⑤
难度: 中等查看答案及解析
-
金属材料的开发一直是材料科学的研究热点,一些新的金属材料相继被开发出来并应用于工农业生产和高科技领域。例如,铀(U)用作核电厂反应堆的核燃料,镅(Am)在烟雾探测器中用作烟雾监测材料;特点是被誉为“21世纪的金属”——钛(Ti),应用前景更为广阔。钛(titanium)是一种活泼金属,但因其表面容易形成致密的氧化物保护膜使它不易跟其他物质反应,而具有一定的抗腐蚀能力。除此之外,它还具有熔点高、硬度大、可塑性强、密度小等优点。根据以上背景资料及所学知识,你认为下列说法中错误的是
A. 钛不属于稀土金属
B. 钛是很好的航天航空材料
C. 钛在空气中不与其他物质反应
D. 钛有较好的抗腐蚀能力,是很好的防腐材料
难度: 简单查看答案及解析
-
将4 g氢氧化钠溶解在10 mL水中,再稀释成1 L,从中取出10 mL,这10 mL溶液的物质的量浓度是
A. 1 mol·L-1 B. 0.1 mol·L-1
C. 0.01 mol·L-1 D. 10 mol·L-1
难度: 中等查看答案及解析
-
除去硝酸钾固体中含有少量的氯化钠,不需要的实验操作是
A. 加热溶解 B. 趁热过滤 C. 蒸发结晶 D. 降温结晶
难度: 简单查看答案及解析
-
常温下,铁、铝等金属与下列物质能反应,且产生氢气的是
A. 浓硫酸 B. 稀硫酸 C. 浓硝酸 D. 稀硝酸
难度: 简单查看答案及解析
-
下列说法正确的是
A. 用澄清石灰水可以鉴别碳酸钠和碳酸氢钠
B. 新制氯水经光照一段时间pH减小
C. 自然界硅元素贮量丰富,并存在大量的单质硅
D. 等质量的碳酸钠与碳酸氢钠分别与足量盐酸反应,产生二氧化碳质量相同
难度: 简单查看答案及解析
-
下列说法中正确是
A. 电解质与非电解质的本质区别是化合物在一定条件下能否导电
B. 水的导电能力很差,所以水是非电解质
C. 酸、碱、盐都属于电解质,其他化合物都是非电解质
D. 溶于水所得溶液能导电的化合物一定是电解质
难度: 简单查看答案及解析
-
决定一定量的气体体积大小的主要因素是
A. 气体分子的大小 B. 气体分子的质量
C. 气体分子间平均距离大小 D. 气体分子间作用力大小
难度: 简单查看答案及解析
-
下列说法中不正确的是
A. 胶体不均一、不稳定,静置后容易产生沉淀;溶液均一、稳定,静置后不产生沉淀
B. 一种透明液体中加入电解质溶液,若有沉淀生成,则该液体不一定是胶体
C. 当有光束通过时,胶体产生丁达尔效应,溶液不能产生丁达尔效应
D. 放电影时,放映室射到银幕上的光柱是由于胶粒对光的散射形成的
难度: 简单查看答案及解析
-
下列粒子不具有还原性的是
A. H2 B. Fe2+ C. I- D. H+
难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数,下列叙述中正确的是
A. 标准状况下,22.4 L水中含有的水分子数为NA
B. 1 mol Fe与足量的盐酸反应电子转移总数为3NA
C. 常温常压下,22 g CO2中含有的氧原子数为NA
D. 500 mL 1 mol·L-1MgCl2溶液中含有Cl﹣数目为0.5NA
难度: 中等查看答案及解析
-
下列变化中只有通过还原反应才能实现的是
A. Fe3+→Fe2+ B. Mn2+→
C. Cl-→Cl2 D. N2O3→HNO2
难度: 简单查看答案及解析
-
下列指定反应的离子方程式正确的是
A. 氯气溶于水:Cl2+H2O===2H++Cl-+ClO-
B. FeSO4溶液与氨水反应的离子方程式:Fe2++2NH3·H2O===Fe(OH)2↓+NH4+
C. 酸性溶液中KIO3与KI反应生成I2:IO3-+I-+6H+===I2+3H2O
D. NaHCO3溶液中加足量Ba(OH)2溶液:2HCO3-+Ba2++2OH-===BaCO3↓+2H2O+CO2↑
难度: 中等查看答案及解析
-
根据S2
+2e-―→2
、Mn2++4H2O―→
+8H++5e-,推测氧化1.5 mol Mn2+需S2
的物质的量为
A. 1.5 mol B. 3.75 mol C. 3.25 mol D. 3.125 mol
难度: 中等查看答案及解析
-
下列关于容量瓶的说法不正确的是
A. 容量瓶上一般标有规格、温度和刻度线
B. 容量瓶在使用前要检查是否漏水
C. 可将固体或浓溶液直接在容量瓶中溶解或稀释
D. 容量瓶不能长时间盛放所配制的溶液,应及时分装在试剂瓶中
难度: 简单查看答案及解析
-
有NO、CO2、N2O4三种气体,它们分别都含有0.5 mol氧原子,则三种气体的物质的量之比为
A. 1∶1∶2 B. 1∶1∶1 C. 4∶2∶1 D. 1∶2∶4
难度: 中等查看答案及解析
-
下列反应可用离子方程式H++OH-===H2O来表示的是
A. 氢氧化钡和稀硫酸的反应 B. 硫酸氢钠和氢氧化钾的反应
C. 碳酸氢钠和氢氧化钾的反应 D. 氢氧化钠溶液与醋酸的反应
难度: 中等查看答案及解析
-
下列说法正确的是
A. 实验室用排水法收集氯气
B. 闻氯气气味时,用手轻轻在集气瓶口扇动,使极少量氯气飘进鼻孔
C. Cl-和Cl2均有毒
D. Cl-和Cl2均呈黄绿色
难度: 简单查看答案及解析
-
某化学小组为测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案Ⅰ:铜铝混合物
 测定生成气体的体积
测定生成气体的体积方案Ⅱ:铜铝混合物
测定剩余固体的质量
下列有关判断中不正确的是
A. 溶液A和B均可以是盐酸或氢氧化钠溶液
B. 溶液A和B均可以选用稀硝酸
C. 若溶液B选用氯化铁溶液,则实验难以实现
D. 实验方案Ⅱ更便于实施
难度: 中等查看答案及解析
-
下列各项正确的是( )
A. 镁、铝与沸水不可能反应
B. 铁在一定条件下可以与水反应
C. 钠与水反应的离子方程式:Na+H2O=Na++OH-+H2↑
D. 钠和硫酸铜溶液反应的离子方程式:2Na+Cu2+=2Na++Cu
难度: 简单查看答案及解析
-
下列关于铁与盐酸反应的叙述不正确的是( )
A. 该反应是置换反应 B. 铁是还原剂
C. 盐酸是氧化剂 D. 产物是氯化铁和氢气
难度: 简单查看答案及解析
-
有下列物质:①干燥的氯气、②过氧化钠、③次氯酸钠、④活性炭、⑤二氧化硫,其中能使品红溶液褪色的是( )
A. 除①外其他都可以 B. ①②③
C. ①④⑤ D. 全部
难度: 中等查看答案及解析
-
有下列氧化物:①FeO、②Fe2O3、③Fe3O4、④CuO,其中颜色相同的是( )
A. ①②③ B. ①②④ C. ②③④ D. ①③④
难度: 简单查看答案及解析
-
由Na、Mg、Al三种金属中的两种组成的混合物共10 g,跟足量的盐酸反应,产生0.5 g标准状况下的氢气,则此混合物中必定含有
A. Al B. Mg C. Na D. 都不可能含有
难度: 中等查看答案及解析
-
某班就“使用金属材料的利与弊”为题进行小组辩论,甲方的观点是使用金属材料有利,下列甲方观点不科学的是
A. 金属材料大多有延展性,可以加工成各种形状
B. 金属材料大多有美丽的光泽
C. 废弃的金属不会造成土壤污染和水污染
D. 金属材料大多数可以回收再利用
难度: 简单查看答案及解析
-
为了除去铁粉中的少量铝粉,可以选取的试剂是
A. 浓盐酸 B. 浓硝酸 C. 浓硫酸 D. 浓氢氧化钠溶液
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A. 氯气与水反应:Cl2+H2O===2H++Cl-+ClO-
B. 氯气与澄清石灰水反应:Cl2+2OH-===Cl-+ClO-+H2O
C. 氯气与氯化亚铁溶液反应:Cl2+Fe2+===2Cl-+Fe3+
D. 金属钠与水反应:Na+2H2O===Na++2OH-+H2↑
难度: 简单查看答案及解析