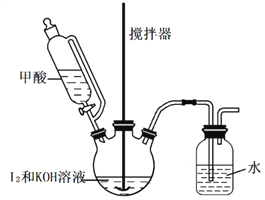
-
化学与科技生产、生活环境等密切相关,下列说法不正确的是( )
A. 有人称“一带一路”是“现代丝绸之路”,丝绸的主要成分是纤维素,属于天然高分子化合物
B. 陶瓷、水泥和玻璃都属于硅酸盐产品
C. 废旧钢材焊接前,可依次用饱和Na2C03溶液、饱和NH4C1溶液处理焊点
D. 使用可降解的聚碳酸酯塑料和向燃煤中加入生石灰,都能减轻环境污染
难度: 中等查看答案及解析
-
(题文)X、Y、Z、W、M五种元素的原子序数依次增大。已知X、Y、Z、W是短周期元素中的四种非金属元素,X元素的原子形成的离子就是一个质子;Y原子的最外层电子数是内层电子数的2倍;Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体;M是地壳中含量最高的金属元素。下列说法正确的是( )
A. X、Z、W三元素形成的化合物为共价化合物
B. 五种元素的原子半径从大到小的顺序是:M>W>Z>Y>X
C. 化合物YW2、ZW2都是酸性氧化物
D. 用M单质作阳极,石墨作阴极电解NaHCO3溶液,在阳极区出现白色沉淀
难度: 简单查看答案及解析
-
某有机物的结构如图所示。有关该物质的下列说法正确的是( )
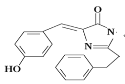
A. 该物质能发生加成反应、取代反应
B. 不能与Br2的CCl4溶液发生反应
C. 该物质中所有原子有可能在同一平面
D. 该化合物的分子式为C18H17O2N2
难度: 中等查看答案及解析
-
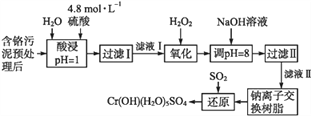
饮茶是中国人的传统饮食文化之一。为方便饮用,可通过以下方法制取罐装饮料茶,上述过程涉及的实验方法、实验操作和物质作用说法 不正确的是
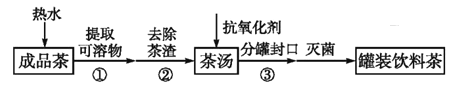
A.
操作利用了物质的溶解性
B.
操作为分液
C.
操作为过滤
D. 加入抗氧化剂是为了延长饮料茶的保质期
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列有关叙述正确的是
A. 18 g D2O所含有电子数为10NA
B. 1mol Na2O2 发生氧化还原反应时,转移的电子数目一定为 2 NA
C. 常温常压下,14 g 由 N2 与 CO 组成的混合气体含有的原子数目为NA
D. 50 mL 18.4 mol·L-1 的浓硫酸与足量铜在加热条件下反应,生成 SO2 分子的数目为0.46 NA
难度: 中等查看答案及解析
-
我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na
2Na2CO3+C。下列说法错误的是( )。
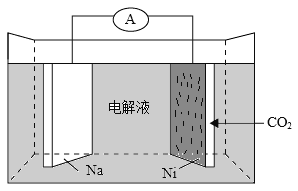
A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e-=2CO32-+C
D. 充电时,正极反应为:Na++e-=Na
难度: 中等查看答案及解析