-
以下说法正确的是 ( )
A. 同分异构体之间分子式相同,其式量也一定相等,式量相等的物质一定是同分异构体。
B. 同分异构体之间某种元素的质量分数均相同,化合物之间某种元素质量分数均相同的物质一定为同分异构体。
C. 两种物质如果互为同分异构体,则一定不可能为同系物。
D. 互为同分异构体的物质之间物理性质一定不同,但化学性质一定相似。
难度: 中等查看答案及解析
-
下列关于有机物的说法正确的是 ( )
A. 乙烯、甲苯、苯乙烯分子中的所有碳原子都在同一平面上
B. 除去乙烷中的乙烯时,通入氢气并加催化剂加热
C. 利用质谱图可以分析有机物含有的化学键和官能团
D. 正丁烷和异丁烷的的核磁共振氢谱都有两个吸收峰
难度: 中等查看答案及解析
-
某烃结构式用键线表示为
,该烃与Br2按物质的量之比为1∶1加成时,所得产物有( )
A. 3种 B. 6种 C. 5种 D. 4种
难度: 中等查看答案及解析
-
维生素A对人体,特别是对人的视力有重大作用,其结构简式如图所示:
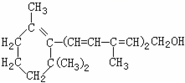
下列关于该化合物的说法正确的是 ( )
A. 分子式为C16H25O
B. 含有苯环结构
C. 该物质1mol一定条件下最多能与3mol氢气反应
D. 分子中含有一种含氧官能团
难度: 中等查看答案及解析
-
主链上有6个碳原子,含有1个甲基和1个乙基两个支链的烷烃有
A. 6种 B. 5种 C. 4种 D. 3种
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是 ( )
A. 1L1mol·L-1的NaClO 溶液中含有ClO-的数目为NA
B. 常温常压下,14g由乙烯与丙烯组成的混合气体含有的原子数目为3NA
C. 1mol·L-1醋酸溶液中所含CH3COOH分子总数一定小于NA
D. 标准状况下,11.2L己烯中含有的碳原子数为3NA
难度: 中等查看答案及解析
-
下列说法与盐类水解有关且正确的是: ( )
A. AlCl3溶液和NaAlO2溶液加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同
B. 配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度
C. 用加热的方法可除去KCl溶液中混有的Fe3+
D. 食醋可以溶解水垢
难度: 简单查看答案及解析
-
下列有关热化学方程式的叙述正确的是 ( )
A. 已知2H2(g)+O2(g)═2H2O(g)△H=﹣483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol
B. 含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=﹣57.4kJ/mol
C. 若反应A=B △H<0,说明A物质比B物质稳定,分子内共价键键能 A比B大
D. 已知C(s)+O2(g)═CO2(g)△H1;C(s)+1/2 O2(g)═CO(g)△H2,则△H1>△H2
难度: 中等查看答案及解析
-
室温下,下列各组离子在指定溶液中一定能大量共存的是 ( )
A. pH=12的溶液中:CO32-、Na+、NO3-、S2-、SO32-
B. 水电离H+浓度c(H+)=10-12 mol/L溶液中:Cl-、CO32-、NO3-、NH4+、SO32-
C. 使石蕊变红的溶液中:Fe2+、MnO4-、NO3-、Na+、SO42-
D. 中性溶液中:Fe3+、Al3+、NO3-、Cl-、
难度: 中等查看答案及解析
-
常温下pH=3的二元弱酸H2R溶液与a L pH=11的NaOH溶液混合后,混合液的pH刚好等于7(假设反应前后体积不变),则对反应后混合液的叙述正确的是
A. c(R2-)+ c(OH-)=c(Na+)+c(H+) B. c(R2-)>c(Na+)>c(H+)=c(OH-)
C. 2c(R2-)+ c(HR-)=c(Na+) D. 混合后溶液的体积为2a L
难度: 中等查看答案及解析
-
下列事实能说明醋酸是弱酸的是 ( )
①当温度低于16.6℃时醋酸可凝结成冰一样晶体 ②0.1 mol/L的醋酸钠溶液的pH约为9
③等体积等物质的量浓度的硫酸比醋酸消耗氢氧化钠多 ④0.1mol/L的醋酸的pH值约为4.8
⑤pH都等于4且等体积的醋酸和盐酸,与足量等浓度NaOH溶液充分反应时,醋酸消耗碱液多
⑥醋酸中滴入石蕊试液呈红色
A. ②④⑤ B. ②④ C. ②③④ D. ②③⑥
难度: 中等查看答案及解析
-
下列排列顺序正确的是
A. 常温下将0.1 mol·L-1NH4Cl溶液与0.05 mol·L-1NaOH溶液等体积混合,c(Cl-) > c(Na+) > c(NH4+) > c (OH-) > c (H+)
B. 常温下,物质的量浓度相等的①NH4HSO4②CH3COONH4③NH4Cl三种溶液中c(NH4+):①>③>②
C. 0.1mol·L-1的NaHA溶液,其pH=11,则溶液中:c(HA-)>c(OH-)>c(A2-)>c(H2A)
D. 在相同条件下,将足量AgCl加入等体积的①0.01 mol•L-1AgNO3溶液②0.1 mol•L-1KCl溶液③蒸馏水三种液体中,所能溶解的AgCl质量关系为:①>②>③
难度: 简单查看答案及解析
-
用下列装置完成相关实验,合理的是 ( )
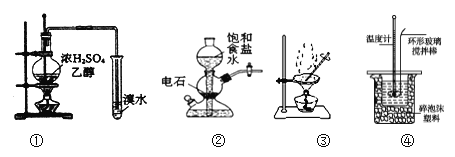
A. 用①制备并检验乙烯 B. 实验室中若需制备较多量的乙炔可用装置②
C. 提纯含苯甲酸钠杂质的粗苯甲酸选择装置③ D. 可用装置④来进行中和热的测定
难度: 中等查看答案及解析
-
草酸(H2C2O4)是二元弱酸(K1=5.9×10-2、K2=6.4×10-5)。向10mL稀H2C2O4溶液中滴加等浓度NaOH溶液,H2C2O4、HC2O4-、C2O42-的浓度分数δ随溶液pH变化的关系如下图,以下说法正确的是( )
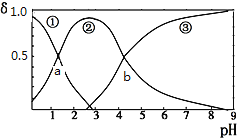
A. HC2O4-的浓度分数随pH增大而增大
B. 交点a处对应加入的NaOH溶液的体积为5mL
C. 交点b处c(H+)=6.4×10-5
D. pH=5时存在c(Na+)+c(H+)=c(C2O42-)+c(HC2O4-)+c(OH-)
难度: 困难查看答案及解析
-
下列实验操作、现象和结论均正确的是
选项
实验操作
现象
结论
A
等体积pH=2的HX和HY两种酸分别与足量的铁反应,用排水法收集气体
HX放出的氢气多且反应速率快
酸的强弱:HX<HY
B
向2 mL 0.1 mol/L Na2S溶液中滴2滴0.1 mol/L ZnSO4溶液;再滴2滴0.1 mol/L CuSO4
先生成白色沉淀,后生成黑色沉淀
溶度积(Ksp):ZnS>CuS
C
向FeCl3和KSCN混合溶液中,加入少量KCl的固体
溶液颜色变浅
FeCl3+3KSCN
Fe(SCN)3 +3KCl平衡向逆反应方向移动
D
常温下,用pH计分别测定饱和NaA溶液和饱和NaB溶液的pH
pH:NaA>NaB
常温下酸性:HA﹤HB
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
银锌蓄电池应用广泛,放电时总反应为Zn+Ag2O2+H2O==Zn(OH)2+Ag2O,某小组以银锌蓄电池为电源,用惰性电极电解饱和Na2SO4溶液制备H2SO4和NaOH,设计如图所示装置。连通电路后,下列说法正确是
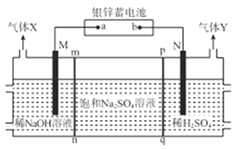
A. 电池的a极反应式为Ag2O2+H2O+2e-=Ag2O+2OH-
B. 气体Y为H2
C. pq膜适宜选择阳离子交换膜
D. 电池中消耗65gZn,理论上生成1mol 气体X
难度: 困难查看答案及解析
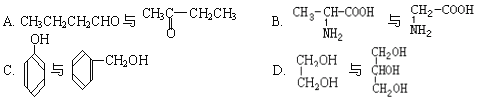
 单体的结构简式________________。
单体的结构简式________________。 恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如图所示: